Bohr mengemukakan teori tentang atom yang bertitik tolak dari model atom nuklir Rutherford dan teori kuantum Planck. [2] Model atom yang diajukan Bohr dikenal sebagai model atom Rutherford-Bohr, yang dapat diterangkan sebagai berikut.
Tokoh Kimia :
Niels (Henrik David) Bohr (1885–1962) adalah seorang kimiawan asal
Denmark. Ia diperhitungkan sebagai salah seorang fisikawan besar pada
abad ke-20 meskipun ia sendiri mengakui dirinya sebagai seorang
kimiawan.Bohr mendapatkan gelar doktornya di Copenhagen University
kemudian ia belajar di Inggris di bawah pengawasan Ernest Rutherford.
Dengan dasar teori atom Rutherford, Bohr melakukan penelitian tentang
teori atom sampai berhasil menemukan teori atomnya sendiri. Bohr
mempublikasikan teori atomnya pada 1913. Teorinya ini kemudian menjadi
dasar terhadap teori kuantum.
artikel ini disalin lengkap dari: http://perpustakaancyber.blogspot.co.id/2013/03/model-dan-kelemahan-teori-atom-bohr-pengertian-gambar.html
halaman utama website: http://perpustakaancyber.blogspot.co.id/
jika mencari artikel yang lebih menarik lagi, kunjungi halaman utama website tersebut. Terimakasih!
1. Elektron-elektron dalam atom hanya dapat melintasi lintasan-lintasan
tertentu yang disebut kulit-kulit atau tingkat-tingkat energi.
2. Elektron yang beredar pada lintasannya tidak memancarkan energi, lintasan elektron ini disebut lintasan / keadaan stasioner.
3. Kedudukan elektron dalam kulit-kulit, tingkat-tingkat energi dapat
disamakan dengan kedudukan seseorang yang berada pada anak-anak tangga.
Seseorang hanya dapat berada pada anak tangga pertama, kedua, ketiga,
dan seterusnya, tetapi ia tidak mungkin berada di antara anak
tangga-anak tangga tersebut.
Apabila elektron dengan tingkat energi rendah pindah ke lintasan dengan
tingkat energi lebih tinggi maka elektron akan menyerap energi,
peristiwa ini disebut eksitasi. Sebaliknya, apabila elektron pindah dari
lintasan dengan tingkat energi lebih tinggi ke lintasan dengan tingkat
energi lebih rendah maka elektron akan memancarkan energi, peristiwa ini
disebut deeksitasi. Baik eksitasi maupun deeksitasi disebut peristiwa
transisi elektron. Energi yang diserap atau dipancarkan pada peristiwa
transisi elektron ini dinyatakan dengan persamaan: [2]
ΔE = hv
Keterangan:
ΔE = perbedaan tingkat energi
h = tetapan Planck = 6,6 × 10–34 J/s
v = frekuensi radiasi
4. Energi yang dipancarkan/diserap ketika terjadi transisi elektron terekam sebagai spektrum atom. [2]
Beberapa kelebihan dan kelemahan dari model atom Bohr, dapat dilihat dalam uraian berikut. [2]
Kelebihan Teori Atom Bohr
- Menjawab kelemahan dalam model atom Rutherford dengan mengaplikasikan teori kuantum.
- Menerangkan dengan jelas garis spektrum pancaran (emisi) atau serapan (absorpsi) dari atom hidrogen.
Kelemahan Teori Atom Bohr
- Terjadi penyimpangan untuk atom yang lebih besar dari hidrogen.
- Tidak dapat menerangkan efek Zaeman, yaitu spektrum atom yang lebih rumit apabila atom ditempatkan pada medan magnet.
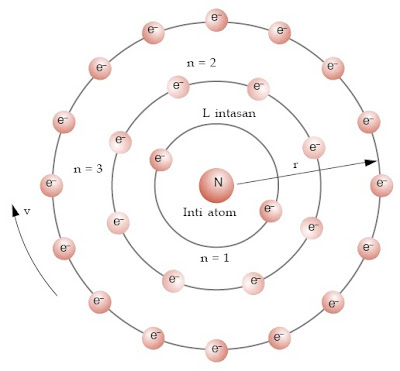 |
| Model atom Bohr. [2] |
Model atom Bohr tersebut dapat dianalogkan seperti sebuah tata surya
mini. Pada tata surya, planet-planet beredar mengelilingi matahari. Pada
atom, elektron-elektron beredar mengelilingi atom, hanya bedanya pada
sistem tata surya, setiap lintasan (orbit) hanya ditempati 1 planet,
sedangkan pada atom setiap lintasan (kulit) dapat ditempati lebih dari 1
elektron.
Dalam model atom Bohr ini dikenal istilah konfigurasi elektron, yaitu
susunan elektron pada masing-masing kulit. Data yang digunakan untuk
menuliskan konfigurasi elektron adalah nomor atom suatu unsur, di mana
nomor atom unsur menyatakan jumlah elektron dalam atom unsur tersebut.
Sedangkan elektron pada kulit terluar dikenal dengan sebutan elektron
valensi. Susunan elektron valensi sangat menentukan sifatsifat kimia
suatu atom dan berperan penting dalam membentuk ikatan dengan atom lain.
Untuk menentukan konfigurasi elektron suatu unsur, ada beberapa patokan yang harus selalu diingat, yaitu:
a. Dimulai dari lintasan yang terdekat dengan inti, masing-masing
lintasan disebut kulit ke-1 (kulit K), kulit ke-2 (kulit L), kulit ke-3
(kulit M), kulit ke-4 (kulit N), dan seterusnya.
b. Jumlah elektron maksimum (paling banyak) yang dapat menempati masing-masing kulit adalah:
2 n2
dengan n = nomor kulit
Kulit K dapat menampung maksimal 2 elektron.
Kulit L dapat menampung maksimal 8 elektron.
Kulit M dapat menampung maksimal 18 elektron, dan seterusnya.
c. Kulit yang paling luar hanya boleh mengandung maksimal 8 elektron.
Niels (Henrik David) Bohr
(1885–1962)
 |
| Niels Henrik David Bohr. [2] |
artikel ini disalin lengkap dari: http://perpustakaancyber.blogspot.co.id/2013/03/model-dan-kelemahan-teori-atom-bohr-pengertian-gambar.html
halaman utama website: http://perpustakaancyber.blogspot.co.id/
jika mencari artikel yang lebih menarik lagi, kunjungi halaman utama website tersebut. Terimakasih!
No comments:
Post a Comment