Salah satu tujuan mempelajari ilmu Kimia adalah mengkaji tentang
bagaimana partikel berukuran sangat kecil bergabung satu dengan lainnya
membentuk struktur materi yang sangat besar seperti kita lihat
sehari-hari, contohnya molekul air. Materi yang kita amati sehari-hari
sesungguhnya tersusun dari sejumlah partikel yang bergabung melalui
ikatan kimia atau gaya antarmolekul. Dengan diketahuinya jenis ikatan
yang memperkokoh partikel, diharapkan kita dapat meramalkan bentuk
geometri suatu materi, khususnya geometri molekul. Bagaimanakah bentuk
dasar suatu molekul? Bagaimanakah antar aksi antarmolekul dan pengaruh
terhadap sifatnya? Anda dapat menjawab pertanyaan-pertanyaan tersebut
jika Anda mempelajari bab ini dengan saksama.
A. Struktur Molekul Dasar
Walaupun jumlah materi di alam sangat banyak dan beragam, tetapi pada
dasarnya materi tersebut dibangun oleh beberapa jenis atom dengan
struktur yang terbatas. Jumlah cara penyusunan atom dalam molekul tidak
banyak sebab dibatasi oleh sudut antar ikatan dan sifat partikel
penyusunnya. Teori yang mengkaji aspek struktur molekul adalah teori
ikatan valensi (berdasarkan mekanika kuantum), teori domain elektron
(berdasarkan teori Lewis), dan teori hibridisasi.
Terdapat sekitar tujuh bentuk molekul
yang sederhana, yaitu bentuk linear, trigonal planar, trigonal
piramidal, segiempat datar, tetrahedral, tirogonal bipiramidal, dan
oktahedral.
1.1. Bentuk Linear
Suatu molekul dikatakan linear jika atom-atom yang menyusun molekul tersebut berada dalam suatu garis lurus. Contohnya, BeCl2 dan CO2. Sudut yang dibentuk oleh ikatan antara dua atom melalui atom pusat sebesar 180°.
1.2. Trigonal Planar
Suatu bentuk molekul dikatakan trigonal planar jika di dalam molekulnya
terdapat empat buah atom dan semua atom berada pada bidang yang sama.
Atom pusat dikelilingi oleh tiga atom lain yang berada pada sudut-sudut
segitiga. Sudut ikatan yang dibentuk di antara dua ikatan melalui atom
pusat sama besar yaitu 120°. Contohnya, molekul BCl3 dan BF3.
1.3. Trigonal Piramidal
Trigonal piramidal adalah suatu bentuk molekul dengan empat buah muka
segitiga sama sisi. Suatu molekul dikatakan berbentuk trigonal piramidal
jika memilki empat buah atom. Atom pusat ditempatkan pada sudut puncak
limas, dan atom lainnya berada pada sudut-sudut limas yang berada pada
bidang datar segitiga. Contohnya, molekul NH3.
1.4. Bujur Sangkar
Suatu bentuk molekul dikatakan bujur sangkar jika dalam molekul terdapat
lima buah atom dan semua atom berada pada bidang datar yang sama. Atom
pusat dikelilingi oleh empat atom lain yang berada pada sudut-sudut
segiempat. Sudut ikatan yang dibentuk antara dua ikatan yang melalui
pusat sama besar, yaitu 90°. Contohnya, molekul XeF4.
1.5. Tetrahedral
Tetrahedral adalah limas segiempat dengan muka segitiga sama sisi. Suatu
bentuk molekul tergolong tetrahedral jika dalam molekulnya terdapat
lima buah atom. Atom pusat ditempatkan pada pusat tetrahedral dan empat
atom lain berada pada sudut-sudut tetrahedral yang terlihat pada
ujung-ujung bidang segitiga sama sisi. Sudut ikatan yang dibentuk sama
besar, yaitu 109,5°. Contohnya, molekul CH4.
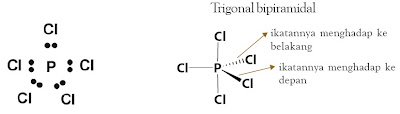
1.6. Trigonal Bipiramidal
Trigonal bipiramidal terdiri atas dua buah limas yang bagian alasnya
berimpit. Suatu molekul memiliki bentuk trigonal bipiramidal jika dalam
molekulnya terdapat enam buah atom. Dalam trigonal bipiramidal, atom
pusat ditempatkan pada pusat alas yang berimpit dan dikelilingi oleh
lima atom lain yang ditempatkan pada sudut-sudut trigonal bipiramidal.
Dalam bentuk molekul ini sudut ikatan tidak sama. Sudut ikatan yang
terletak pada pusat bidang datar segitiga masing-masing 120°, sedangkan
sudut ikatan antara bidang pusat dan titik sudut atas serta bawah bidang
adalah 90°. Contohnya, molekul PCl5.
1.7. Oktahedral
Oktahedral adalah bentuk yang memiliki delapan muka segitiga, dibentuk
dari dua buah limas alas segiempat yang berimpit. Suatu molekul memiliki
bentuk oktahedral jika tersusun dari tujuh atom. Atom pusat ditempatkan
pada pusat bidang segiempat yang berimpit. Enam atom lain terletak pada
sudut-sudut oktahedral. Sudut antar ikatan yang terbentuk sama besar,
yaitu 90°. Contohnya, molekul SF6 dan XeF6.
Metode yang dapat digunakan untuk meramalkan bentuk molekul adalah model
rumus titik-elektron yang diperluas menjadi teori domain elektron atau
teori tolakan pasangan elektron kulit valensi (VSEPR, Valence Shell
Electron Pair Repulsion). Seperangkat aturan dikemas ke dalam teori
domain elektron yang memungkinkan Anda dapat meramalkan bentuk molekul
secara tepat. Teori ini didasarkan pada jumlah pasangan elektronikatan
dan pasangan elektron bebas dalam kulit valensi atom pusat suatu
molekul. Teori ini menyatakan bahwa bentuk molekul dapat ditentukan
berdasarkan tolakan pasangan elektron dalam kulit valensi atom pusat.
Oleh karena itu, teori ini disebut teori domain elektron atau VSEPR.
Bagaimana teori ini dapat diterapkan untuk memprediksi bentuk suatu
molekul? Untuk mempermudah mempelajarinya, molekul-molekul akan
dikelompokkan ke dalam tiga kategori, yaitu molekul-molekul yang
memiliki atom pusat:
- berikatan kovalen tunggal yang jenuh;
- berikatan kovalen tunggal yang tidak jenuh (memiliki elektron bebas); dan
- berikatan kovalen rangkap.
2.1. Bentuk Molekul Tanpa Elektron Bebas
Simak molekul BeCl2 dengan menggunakan rumus Lewis yang ditunjukkan Gambar 1.
 |
| Gambar 1. (a) Struktur Lewis BeCl2 (b) Bentuk molekul BeCl2 (linear) |
Sebagai atom pusat adalah berilium dengan dua elektron valensi. Kedua
elektron tersebut digunakan untuk berikatan kovalen dengan atom-atom
klorin membentuk dua ikatan kovalen tunggal. Pasangan elektron ikatan
dalam kulit valensi atom pusat akan mengalami tolakan disebabkan
muatannya sejenis. Guna meminimalkan tolakan tersebut maka pasangan
elektron ikatan akan menjauh satu sama lain. Menurut pendapat Anda, pada
posisi bagaimana tolakan akan minimal? Tolakan minimum dicapai jika
pasangan elektron ikatan berada pada posisi dengan sudut 180°. Oleh
karena sudut ikatan yang terbentuk antara atom klorin dan atom klorin
yang lain melalui titik pusat (atom Be) membentuk 180° maka bentuk
molekul yang paling mungkin adalah linear.
Sekarang, tinjau molekul dengan tiga pasang elektron ikatan dalam kulit
valensi atom pusat. Contoh dari molekul ini adalah boron triklorida, BeCl3, rumus Lewisnya ditunjukkan Gambar 2a.
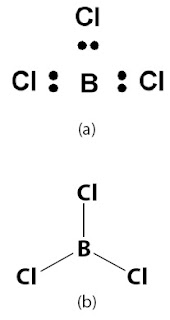 |
| Gambar 2. (a) Struktur Lewis BeCl3 (b) Bentuk molekul BeCl3 (trigonal planar). |
Tiga pasang elektron ikatan dalam kulit valensi atom pusat berusaha
meminimalkan tolakan dengan cara memposisikan sejauh mungkin satu sama
lain. Tolakan akan minimum jika ketiga pasang elektron ikatan berada
pada posisi 120° satu sama lain. Akibatnya, bentuk molekul yang
terbentuk adalah trigonal planar dengan atom pusat berada di
tengah-tengah segitiga.
Sudah pahamkah Anda dengan dua contoh bentuk molekul pada Gambar 2? Jika
belum paham, simak contoh penerapan teori domain elektron dalam bentuk
molekul yang lain.
Contoh Soal 1 (Meramalkan Bentuk Molekul dengan Ikatan Kovalen Jenuh)
Ramalkan bentuk molekul PCl5.
Penyelesaian :
a. Tentukan atom pusat dan jumlah elektron valensi;
b. gambarkan struktur Lewisnya; dan
c. ramalkan bentuk molekulnya.
Molekul PCl5 memiliki atom pusat P (atom pusat biasanya memiliki nilai keelektronegatifan yang lebih kecil daripada atom penyusun lainnya).
Struktur lewis dari molekul PCl5 sebagai berikut:
15P =
[Ne] 3s2 3p3
Atom P memiliki 5 elektron valensi. Kelima elektron ini membentuk ikatan kovalen tunggal dengan 5 atom Cl.
Struktur Lewis PCl5 :
Bentuk molekul dengan lima pasang elektron ikatan dengan tolakan minimum adalah trigonal bipiramidal .
2.2. Molekul Kovalen Tunggal Tidak Jenuh
Molekul-molekul yang berikatan kovalen tunggal dan tidak jenuh adalah
molekul-molekul dengan atom pusat yang memiliki pasangan elektron bebas
atau tidak digunakan untuk berikatan. H2O, NH3,
PCl3, dan yang sejenis adalah contoh dari molekul
jenis ini. Bagaimana meramalkan bentuk molekul yang memiliki pasangan
elektron bebas (PEB)?
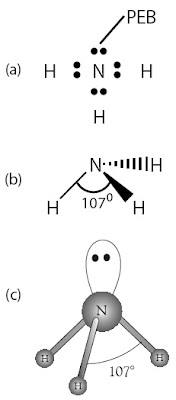 |
| Gambar 3. (a) Struktur Lewis NH3 (b) Bentuk molekul NH3 (trigonal piramidal) (c) Struktur ruang pasangan elektron dalam kulit valensi atom N (tetrahedral) |
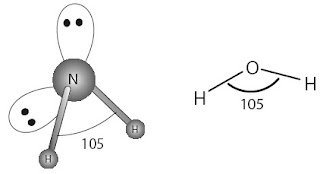
Simak molekul NH3 dengan atom pusat N dan memiliki 5 elektron valensi. Rumus Lewis molekul NH3 itunjukkan
oleh Gambar 3a. Pada atom N terdapat empat pasang elektron dalam kulit
valensi. Tiga pasang merupakan pasangan elektron ikatan (PEI) dengan
atom H dan satu pasang merupakan pasangan elektron bebas (PEB). Antara
keempat pasang elektron dalam kulit valensi atom N terjadi tolakan satu
sama lain sedemikian rupa sehingga dicapai tolakan minimum antara
pasangan elektron tersebut. Berdasarkan data empirik, diketahui bahwa
molekul NH3 berbentuk limas alas segitiga dengan sudut ikatan 107° (Gambar 3b). Bagaimana fakta ini dapat dijelaskan?
Oleh karena terdapat empat pasang elektron dalam kulit valensi atom N
maka struktur ruang pasangan elektron yang paling mungkin adalah
tetrahedral. Bentuk ini dapat diterima, seperti terlihat pada Gambar 3c.
Akan tetapi, sudut ikatan dalam NH3 tidak sesuai dengan sudut
tetrahedral, yakni 109°.
Jika tolakan antarpasangan elektron dalam kulit valensi atom N sama
besar maka sudut ikatan harus 109°. Oleh karena faktanya 107°, ada
perbedaan kekuatan tolakan antara PEI dan PEB, di mana PEB menolak lebih
kuat dari PEI sehingga sudut ikatan di antara ketiga PEI lebih kecil
dari sudut ikatan tetrahedral.
Hipotesis tersebut ternyata sangat tepat dan beralasan bahwa PEB menolak
lebih kuat dari PEI sebab pasangan elektron bebas memerlukan ruang
lebih besar dibandingkan pasangan elektron ikatan. Pada PEB, pergerakan
elektron lebih leluasa dibandingkan PEI yang kaku dan tegar akibat
terikat di antara dua atom. Akibatnya, PEB memerlukan ruang gerak yang
lebih besar dari PEI dan berdampak pada tolakan PEB lebih besar
dibandingkan tolakan di antara PEI.
Contoh Soal 2 (Meramalkan Bentuk Molekul dengan Ikatan Kovalen Tidak Jenuh)
Ramalkan bentuk molekul H2O? Diketahui sudut ikatan antara H–O–H sebesar 105°.
Pembahasan :
a. Tentukan atom pusat dan jumlah elektron valensi.
b. Gambarkan struktur Lewisnya.
c. Ramalkan bentuk molekulnya dengan mempertimbangkan tolakan PEB > PEI.
Molekul H2O memiliki atom pusat O.
Struktur Lewis H2O sebagai berikut:
8O =
[He] 2s2 2p4
Atom O memiliki 6 elektron valensi, dua elektron berikatan dengan atom H dan sisanya sebagai PEB.
Struktur Lewis H2O :
Pada molekul H2O ada 4 pasang elektron dalam kulit valensi atom O, yaitu 2 PEI dan 2 PEB.
Oleh karena ada 4 pasang elektron dalam kulit valensi atom O, struktur
ruang pasangan elektron yang dapat dibentuk adalah tetrahedral. Merujuk
pada fakta bahwa sudut ikatan dalam H2O 105°, sedangkan sudut ikatan dalam tetrahedral 109° maka terjadi distorsi terhadap bentuk molekul tetrahedral.
Distorsi ini akibat tolakan antara kedua PEB lebih besar dibandingkan
antara kedua PEI, akibatnya sudut yang dibentuk oleh molekul H2O lebih kecil dari 109°. Simak struktur ruang pasangan elektron dalam molekul H2O berikut.
Strukturnya membentuk tetrahedral terdistorsi, sedangkan bentuk molekul dari H2O berupa huruf “V” (tidak linear sebagaimana pada molekul triatom yang lain, seperti BeCl2 atau CO2).
2.3. Molekul Kovalen Berikatan Rangkap
Bagaimanakah pandangan teori domain elektron terhadap molekul yang
memiliki ikatan kovalen rangkap dua atau rangkap tiga? Menurut teori
domain elektron, ikatan rangkap dianggap sebagai satuan gugus elektron
seperti halnya ikatan tunggal yang menghubungkan atom dengan atom pusat
M. Contohnya, molekul CO2 yang mengandung ikatan rangkap dua. Menurut teori domain elektron, bentuk molekul CO2 dapat dianggap sebagai dua gugus pasangan elektron ikatan, seperti pada molekul BeCl2. Oleh karena itu, bentuk molekul CO2 dianggap linear (perhatikan Gambar 4a).
 |
| Gambar 4. (a) Struktur Lewis dan bentuk molekul CO2 (b) Struktur Lewis dan bentuk molekul HCN. |
Contoh molekul lain dengan ikatan rangkap tiga adalah HCN. Pada molekul
HCN ada dua gugus pasangan elektron pada atom pusat C, yaitu pasangan
elektron ikatan dengan H dan tiga pasangan elektron ikatan dengan N
(ikatan rangkap tiga) sehingga diramalkan memiliki bentuk molekul linear
(perhatikan Gambar 4b).
Contoh Soal 3 (Meramalkan Geometri Molekul Berikatan Rangkap) :
Ramalkan bentuk molekul formaldehida, HCOH.
Jawaban:
a. Gambarkan struktur Lewisnya.
b. Ramalkan bentuk molekulnya dengan menganggap ikatan rangkap sebagai ikatan tunggal.
Oleh karena ikatan rangkap dua antara C dan O dianggap sebagai ikatan tunggal maka bentuk molekul H2CO dapat dikategorikan sebagai molekul MX3. Bentuk molekul MX3 adalah trigonal planar.
Berapakah sudut ikatan yang terbentuk dalam molekul formaldehida pada
Contoh 3? Tentu Anda akan menduga 120° sebab bentuk molekulnya trigonal
planar. Walaupun ikatan rangkap diperlakukan sebagai satu gugusan
elektron seperti ikatan tunggal, tetapi ikatan rangkap memiliki
kerapatan muatan elektron lebih tinggi daripada ikatan tunggal.
Akibatnya, tolakan ikatan rangkap terhadap ikatan tunggal lebih kuat dan
berdampak pada sudut ikatan.
Kekuatan tolakan ikatan rangkap serupa dengan PEB sehingga sudut ikatan H–C–H dalam molekul H2CO tidak sama besar dengan sudut ikatan H–C = 0. Hasil kajian menunjukkan sudut ikatan sebesar 116° dan 122° (lihat Gambar 5).
 |
| Gambar 5. Sudut ikatan H-C-H berbeda dengan H-C=O. |
Berdasarkan uraian tersebut, dapatkah Anda menyimpulkan teori domain
elektron dalam memprediksi struktur molekul? Andaikan M menyatakan atom
pusat, X menyatakan atom yang terikat pada atom pusat, dan pasangan
elektron bebas dinyatakan dengan E maka rumus bentuk molekul dapat
diungkapkan sebagai MXmEn, dengan
m adalah jumlah ligan dan n adalah jumlah pasangan elektron bebas dalam
kulit valensi atom pusat. Berdasarkan rumusan tersebut, Anda dapat
menyatakan molekul dengan rumusan tersebut. Contohnya, CH4 sebagai MX4,
NH3 sebagai MX3E, dan H2O sebagai MX2E2.
Hasil-hasil yang dicapai dengan teori domain elektron dalam meramalkan bentuk molekul untuk molekul-molekul berikatan tunggal dan rangkap disajikan pada Tabel 2.1 berikut.
Tabel 1 Teori Domain Elektron dalam Meramalkan Bentuk Molekul.
Pasangan
Elektron
|
Struktur
Ruang
Pasangan
Elektron
|
Bentuk Molekul
|
Kelompok
|
Contoh
Molekul
|
||
Total
|
Ikatan
|
Bebas
|
||||
2
|
2
|
0
|
Linear
|
Linear
|
MX2
|
BeCl2
|
3
|
3 2
|
0 1
|
Trigonal planar
|
Trigonal planar
Huruf
|
MX3
MX2E
|
BH3
dan BCl
SnCl2
|
4
|
4 3 2
|
0 1 2
|
Tetrahedral
|
Tetrahedral
Trigonal
piramidal
Huruf
|
MX4
MX3E
MX2E2
|
CCl4
dan SiH
NH3
dan PCl
H2O
dan SCl
|
5
|
5 4 3 2
|
0 1 2 3
|
Trigonal
bipiramidal
|
Trigonal
bipiramidal
Disfenoidal
Bentuk–T
Linear
|
MX5
MX4E
MX3E2
MX2E3
|
PCl5
dan PF5
SF4
ClF3
XeF2
|
6
|
6 5 4
|
0 1 2
|
Oktahedral
|
Oktahedral
Piramida alas
bujur sangkar
Bujur sangkar
|
MX6
MX5E
MX4E2
|
SF6
ClF5
XeF4
|
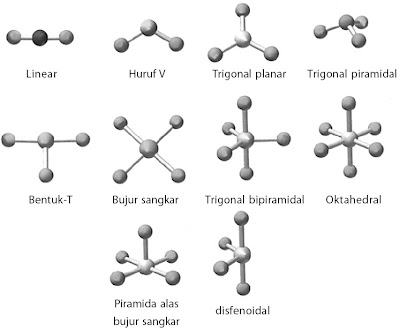 |
| Gambar 6. Bentuk molekul berdasarkan teori domain elektron. |
Teori domain elektron sangat bermanfaat untuk meramalkan bentuk molekul sederhana, tetapi teori tersebut tidak menjelaskan bagaimana elektron-elektron dalam kulit terluar dari atom pusat dapat membentuk struktur tertentu. Untuk mengetahui hal ini dapat dijelaskan dengan hibridisasi orbital atom sebagai implementasi dari teori ikatan valensi.
3.1. Prinsip Umum Teori Ikatan Valensi
Menurut teori ikatan valensi, ikatan akan terbentuk antara dua atom jika memenuhi syarat sebagai berikut.
- Ketika membentuk ikatan, orbital-orbital pada atom pusat mengadakan restrukturisasi melalui proses hibridisasi membentuk orbital hibrida. Selanjutnya, orbital hibrida ini berikatan dengan orbital atom lain.
- Orbital-orbital yang berikatan harus bertumpang tindih (overlapping) satu sama lain.
- Jumlah elektron dalam orbital ikatan yang bertumpang tindih maksimal dua elektron dengan spin berlawanan.
- Kekuatan ikatan bergantung pada derajat tumpang tindih. Semakin besar daerah tumpang tindih, semakin kuat ikatan yang terbentuk.
- Orbital-orbital atom selain orbital-s dalam berikatan memiliki arah tertentu sesuai orientasi orbital atom yang berikatan.
Contoh :
Tinjau molekul CH4, empat atom hidrogen berikatan dengan atom karbon melalui ikatan kovalen, atom karbon sebagai atom pusat. Ikatan ini terbentuk melalui tumpang tindih orbital sp3 dari atom karbon dengan orbital 1s dari atom hidrogen.
Kedua orbital yang berikatan (1s-sp3) dilokalisasikan sepanjang ikatan C–H. Oleh karena itu, orbital yang terbentuk dinamakan orbital ikatan terlokalisasi yang diorientasikan pada daerah di antara atom karbon dan hidrogen.
Model orbital ikatan terlokalisasi merupakan aplikasi teori ikatan valensi yang dikembangkan oleh Linus Pauling.
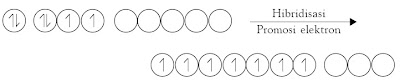
3.2. Hibridisasi Orbital Atom
Apakah yang dimaksud dengan hibridisasi? Hibridisasi adalah proses pencampuran orbital-orbital atom membentuk orbital baru dengan tingkat energi berada di antara orbital-orbital yang dicampurkan. Orbital hasil pencampuran dinamakan orbital hibrida.
Mengapa orbital-orbital berhibridisasi? Untuk dapat menjawab hal ini, tinjau molekul CH4 yang dibentuk dari satu atom karbon dan empat atom hidrogen dihubungkan dengan konfigurasi elektron atom karbon.
Konfigurasi elektron atom karbon dengan nomor atom 6 sebagai berikut.
6C: 1s2 2s2 2p2
Jika Anda perhatikan konfigurasi elektron valensi tersebut, atom karbon
hanya memiliki 2 elektron yang tidak berpasangan. Seharusnya, atom
karbon maksimal mengikat 2 atom hidrogen membentuk CH2, seperti pada molekul PCl3 (Gambar 8). Perhatikan Gambar 7.
Mengapa atom karbon dapat membentuk empat ikatan kovalen dengan
atom-atom lain? Kasus ini dan untuk semua molekul yang lain dapat
dijelaskan dengan pendekatan hibridisasi.
 |
| Gambar 7. Orbital sp3 dari atom C bertumpang tindih dengan orbital s dari atom H. |
 |
| Gambar 7. Pada PCl3, elektron dari setiap atom Cl berikatan dengan elektron dari atom P membentuk 3 pasang elektron ikatan. |
Oleh karena tingkat energi orbital 2s dan 2p tidak berbeda jauh maka
dimungkinkan orbital-orbital tersebut berhibridisasi membentuk orbital
yang baru ketika akan membentuk ikatan dengan atom-atom lain. Bagaimana
proses terjadinya hibridisasi orbital-orbital pada atom pusat?
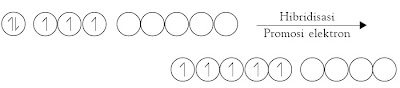
Simak kembali molekul CH4. Ketika atom hidrogen mendekati atom karbon, terjadi perubahan tingkat energi orbital-orbital pada atom karbon sedemikian rupa sehingga dimungkinkan terjadinya hibridisasi orbital-orbital valensi atom karbon.
Oleh karena orbital-orbital hibrida yang dibentuk memiliki tingkat
energi yang sama (di antara 2s dan 2p) maka elektron yang berasal dari
orbital 2s dipromosikan ke orbital p3 yang masih kosong. Orbital hibrida tersebut dinamakan orbital sp3 karena berasal dari satu orbital-s dan tiga orbital-p.
Dalam proses hibridisasi, berlaku hukum kekekalan orbital. Artinya
jumlah orbital sebelum dan sesudah dicampurkan sama. Jadi, hibridisasi
satu orbital-s dan tiga orbital-p akan terbentuk empat orbital sp3.
3.3. Bentuk Molekul dan Valensi Terarah
Menurut teori ikatan valensi, pada pembentukan ikatan, orbital-orbital hibrida dari atom pusat harus bertumpang tindih dengan orbital atom lain dengan arah tertentu. Pada molekul CH4, orbital hibrida sp3 dari atom karbon akan bertumpang tindih dengan orbital-s dari atom hidrogen membentuk ikatan terlokalisasi sp3-s sepanjang sumbu ikatan C–H. Oleh karena ikatan yang terbentuk memiliki orientasi tertentu dalam ruang maka ikatan ini disebut ikatan valensi terarah.
Bentuk molekul yang dibangun oleh CH4 ditentukan oleh orientasi orbital hibrida sp3 dalam atom karbon. Dengan kata lain, bentuk molekul ditentukan oleh struktur orbital hibrida pada atom pusat. Mengapa orbital hibrida memiliki struktur?
Selain orbital-s, orbital-p dan orbital-d memiliki orientasi tertentu dalam ruang. Orbital-orbital hibrida yang terbentuk dari orbital-orbital atom juga memilki struktur tertentu di dalam ruang. Jenis orbital hibrida yang dapat dibentuk dari kombinasi orbital s, p, dan d adalah orbital hibrida sp, sp2, sp3, dsp3, sp3d2, atau d2sp3. Orbital-orbital tersebut memiliki orientasi tertentu dalam ruang.
a. Struktur Linear
Struktur molekul BeH2 menurut prediksi teori domain elektron adalah linear. Bagaimana menurut pandangan teori ikatan valensi dengan pendekatan hibridisasinya?
Atom pusat pada molekul BeH2 adalah berilium dengan konfigurasi elektron 4Be: 1s2 2s2 2p0. Jika dilihat dari konfigurasi elektronnya, atom Be tidak memiliki elektron yang tidak berpasangan. Jadi, tidak mungkin dapat berikatan membentuk molekul, tetapi faktanya atom Be dapat membentuk molekul BeH2. Agar atom Be dapat berikatan dengan atom H maka orbitalorbital 2s pada kulit valensi mengadakan hibridisasi dengan orbital 2p yang masih kosong, diikuti promosi elektron dari orbital 2s ke orbital 2p. Hasilnya adalah :
Contoh Soal 4 (UNAS 2005) :
Berdasarkan tabel berikut :
Senyawa
|
Mr
|
Titik Didih
|
NH3
|
17
|
–33
|
PH3
|
34
|
–88
|
AsH3
|
78
|
–55
|
SbH3
|
125
|
–17
|
Molekul PH3 memiliki titik didih terendah penyebabnya adalah ....
A. Mr terkecil
B. Molekulnya kecil
C. Terdapatnya ikatan hidrogen
D. Terdapatnya ikatan gaya London
E. Terdapatnya ikatan gaya Van der Waals
Pembahasan :
Pada molekul PH3, terdapat gaya Van der Waals. Ikatan Van der Waals jauh lebih lemah daripada ikatan hidrogen pada molekul NH3. Karenanya PH3 memiliki titik didih terendah (E)
Pembentukan orbital hibrida sp dapat ditunjukkan pada gambar berikut.
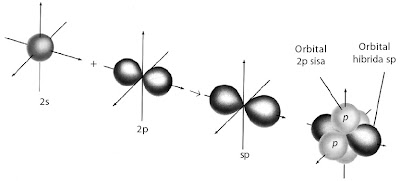 |
| Gambar 9. Pembentukan orbital hibrida sp. Hibridisasi orbital atom s dan orbital atom p menghasilkan orbital hibrida sp dengan orientasi ruang membentuk sudut 180°. |
Orbital hibrida sp memiliki dua aspek penting, yaitu:
- Setiap orbital menyediakan daerah tumpang tindih yang cukup besar dengan orbital 1s dari atom hidrogen.
- Orbital-orbital tersebut memiliki orientasi 180° satu sama lain.
Dua orbital 2p yang tidak digunakan membentuk orbital hibrida berada
pada posisi tegak lurus satu sama lain terhadap sumbu yang dibentuk oleh
orbital hibrida sp.
Setiap orbital hibrida sp dalam atom Be bertumpang tindih dengan orbital 1s dari atom H membentuk dua orbital ikatan terlokalisasi yang setara (lihat Gambar 10). Setiap ikatan Be–H dalam molekul BeH2 disebut ikatan-σ (sigma) dan struktur molekul yang terbentuk adalah linear.
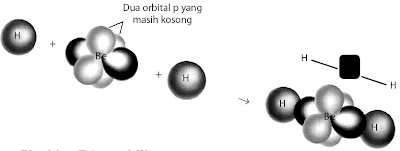 |
| Gambar 10. Pembentukan ikatan-σ yang terlokalisasi sepanjang sumbu ikatan dalam molekul BeH2. |
b. Struktur Trigonal Planar
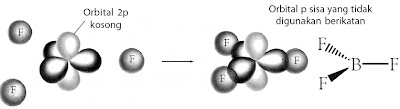
Molekul BF3 menurut teori domain elektron memiliki bentuk molekul trigonal planar. Bagaimana menurut pandangan teori ikatan valensi berdasarkan pendekatan hibridisasinya?
Atom pusat pada molekul BF3 adalah boron dengan konfigurasi elektron 5B: 1s2 2s2 2p1. Jika dilihat dari konfigurasi elektronnya, atom B memiliki satu elektron yang tidak berpasangan. Jadi, hanya satu ikatan yang dapat dibentuk dengan atom F, tetapi faktanya atom B dapat mengikat tiga atom fluorin membentuk molekul BF3.
Agar atom B dapat berikatan dengan tiga atom F maka orbital-orbital 2s pada kulit valensi mengadakan hibridisasi dengan orbital 2p, diikuti promosi elektron dari orbital 2s ke orbital 2p. Hasilnya adalah sebagai berikut.
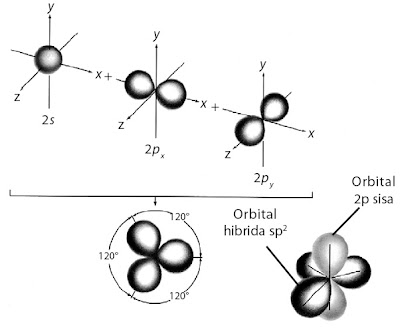
Pembentukan orbital hibrida sp2 ditunjukkan pada gambar berikut.
Untuk membentuk tiga ikatan yang setara, atom boron harus menyediakan
tiga orbital setengah penuh. Hal ini dapat dicapai melalui hibridisasi
orbital 2s dan dua orbital 2p membentuk orbital hibrida sp2.
Oleh karena ketiga orbital setara maka struktur yang terbentuk trigonal planar yang simetri. Masing-masing elektron valensi dalam orbital hibrida sp2 tidak berpasangan dengan spin sejajar (aturan Hund).
Molekul BF3 dibentuk melalui tumpang tindih orbital hibrida sp2 dari boron dan orbital 2pz dari fluorin membentuk tiga orbital ikatan sigma terlokalisasi. Bentuk molekul BF3 yang terbentuk adalah trigonal planar, seperti ditunjukkan pada gambar berikut.
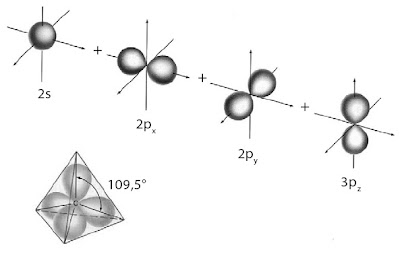
c. Struktur Tetrahedral
Orbital hibrida sp3 dapat dibentuk melalui kombinasi orbital s dan tiga orbital p. Orbital sp3 yang dibentuk ekuivalen dalam ukuran maupun tingkat energinya. Akibatnya, keempat orbital hibrida sp3 membentuk tetrahedral yang simetris di sekitar atom pusat dan molekul yang dibentuk melalui orbital hibrida sp3 memiliki struktur tetrahedral. Orientasi orbital hibrida sp3 ditunjukkan pada Gambar 13. berikut.
Oleh karena keempat orbital setara maka struktur yang terbentuk adalah
tetrahedral. Masing-masing elektron valensi dalam orbital hibrida sp3 tidak berpasangan dengan spin sejajar (aturan Hund). Molekul CH4 dibentuk melalui tumpang tindih orbital hibrida sp3 dari atom C dan orbital 1s dari atom H membentuk empat orbital ikatan sigma terlokalisasi. Bentuk molekul CH4 adalah tetrahedral, sama seperti struktur orbital hibrida sp3 (lihat Gambar 14).
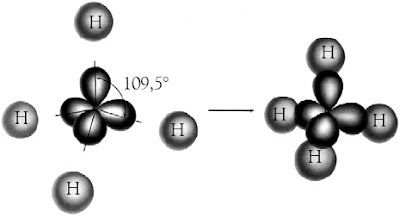 |
| Gambar 14. Empat orbital ikatan terlokalisasi dalam CH4 dibentuk melalui tumpang tindih orbital hibrida sp3 pada atom C dan 1s dari atom H. |
Sebagaimana diramalkan oleh teori domain elektron, bentuk molekul CH4 tetrahedral dan keempat ikatan C–H setara. Keempat orbital ikatan terlokalisasi dalam CH4 dibentuk melalui tumpang tindih orbital sp3 dan orbital 1s dari atom hidrogen.
d. Struktur Trigonal Bipiramidal dan Oktahedral
Struktur trigonal bipiramidal dan oktahedral merupakan kasus menarik dalam teori ikatan valensi dengan hibridisasinya. Orbital hibrida yang terbentuk melibatkan orbital-d dan senyawa yang terbentuk tergolong superoktet. Contoh molekul dengan bentuk trigonal bipiramidal adalah PCl5 dan contoh molekul oktahedral adalah SF6.
Tinjau molekul PCl5 dengan atom P sebagai atom pusat. Konfigurasi elektronnya: 15P : 1s2 2s2 2p6 3s2 3p3 3d0. Hibridisasi satu orbital 3s, tiga orbital 3p dan satu orbital 3d menghasilkan lima orbital hibrida sp3d dengan struktur trigonal bipiramidal yang simetris. Kelima orbital hibrida sp3d memiliki sifat-sifat menarik sebab ada dua orbital hibrida yang tidak setara.
Orbital-orbital hibrida sp3d membentuk dua susunan yang tidak setara.
Susunan pertama terdiri atas tiga orbital hibrida ekuilateral yang setara dan susunan kedua terdiri dari dua orbital aksial yang setara. Kelima orbital ikatan P–Cl dibentuk melalui tumpang tindih setiap orbital hibrida sp3d dengan orbital 3p dari atom klorin. Sepuluh elektron valensi menghuni lima orbital ikatan sigma terlokalisasi membentuk lima ikatan kovalen terlokalisasi.
Pada struktur oktahedral diperlukan enam orbital dengan elektron tidak berpasangan. Keenam orbital tersebut dibentuk melalui hibridisasi 1 orbital s, 3 orbital p, dan 2 orbital d membentuk orbital hibrida sp3d2. Pada molekul SF6, orbital pada kulit valensi atom S mengadakan hibridisasi membentuk orbital hibrida sp3d2 dengan struktur oktahedral.
Keenam orbital sp3d2 bertumpang
tindih dengan orbital 2p dari atom fluorin membentuk enam ikatan S–F
terlokalisasi yang setara dengan struktur oktahedral.
Contoh Soal 5 (Ebtanas 1995) :
Jumlah pasangan terikat atom pusat suatu molekul senyawa = 3, sedangkan
pasangan elektron bebasnya = 0. Bentuk molekulnya adalah ....
A. Oktahedral
B. Trigonal planar
C. Tetrahedral
D. Trigonal bipiramidal
E. Linear
Pembahasan :
Molekul yang stabil memiliki tolakan minimum antar pasangan elektronnya. Atom pusat dengan 3 pasang elektron terikat dan tanpa pasangan elektron bebas, memiliki tolakan minimum dalam bentuk geometri segitiga sama sisi. Jadi, jawabannya (B)
3.4. Hibridisasi dalam Molekul yang Memiliki Pasangan Elektron Bebas
Bagaimanakah hibridisasi dalam molekul yang memiliki pasangan elektron bebas pada atom pusatnya, misalnya H2O dan NH3. Hal ini dapat dijelaskan dengan orbital hibrida sp3 pada atom pusatnya. Tinjau molekul H2O dengan atom O sebagai atom pusat:
Dua orbital ikatan dalam molekul H2O dapat dipandang sebagai tumpang tindih orbital 1s dari atom H dan satu orbital sp3 dari atom O membentuk dua orbital ikatan sigma O–H. Bentuk struktur orbital hibrida sp3 yang terjadi dalam molekul H2O dapat diperhatikan pada Gambar 15.
Terdapat delapan elektron valensi dalam molekul H2O,
enam dari atom O dan dua dari atom H. Empat elektron valensi menghuni
dua orbital ikatan sigma O–H. Empat elektron lainnya menghuni dua
orbital sp3 yang tidak berikatan dan membentuk dua pasang elektron bebas pada atom oksigen.
Menurut teori domain elektron, sudut ikatan H–O–H dalam molekul H2O lebih kecil dari sudut tetrahedral murni sebab pasangan elektron bebas menolak lebih kuat terhadap pasangan elektron ikatan sehingga terjadi distorsi bentuk molekul dari tetrahedral murni. Jadi, jelas bahwa dalam molekul H2O terjadi hibridisasi sp3 ada atom oksigen.
3.5. Hibridisasi dalam Senyawa Hidrokarbon
Apakah hibridisasi terjadi pada senyawa karbon, khususnya ikatan pada karbon-karbon? Tinjau molekul etana (C2H6) dengan struktur molekul ditunjukkan berikut.
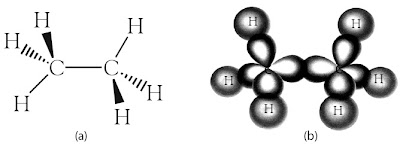 |
| Gambar 16. (a) Struktur molekul etana (b) Struktur orbital pada molekul etana. |
Bentuk molekul etana dapat dijelaskan dengan orbital hibrida sp3 pada kedua atom karbon. Ikatan C–C dibentuk melalui tumpang tindih antara orbital sp3 dan orbital sp3 dari masing-masing atom karbon. Enam ikatan C–H dibentuk melalui tumpang tindih orbital sp3 sisa dan orbital 1s dari atom H. Struktur orbital pada molekul etana ditunjukkan pada Gambar16b.
Ikatan yang terbentuk antara karbon-karbon maupun karbon hidrogen adalah
ikatan sigma yang terlokalisasi. Sehingga, akibat dari ikatan sigma
yang terlokalisasi tersebut akan membentuk struktur tetrahedral murni.
a. Hibridisasi dalam Ikatan Rangkap Dua
Salah satu molekul paling sederhana yang mengandung ikatan rangkap dua karbon-karbon adalah etena (C2H4). Atom-atom pada etena terletak pada satu bidang datar dan masing-masing atom karbon berikatan dengan dua atom lain membentuk struktur trigonal planar. Oleh karena masing-masing atom karbon membentuk trigonal planar, hal ini menandakan terbentuknya orbital hibrida sp2 pada setiap atom karbon. Oleh karena itu, ikatan dalam etena dapat dijelaskan dengan orbital hibrida sp2. Setiap atom karbon masing-masing mengikat dua atom hidrogen melalui tumpang tindih orbital hibrida sp2 dan orbital 1s. Ikatan yang dibentuk semuanya berikatan sigma.
Ikatan antara karbon-karbon ada dua macam. Pertama orbital sp2 dari masing-masing atom karbon bertumpang tindih membentuk ikatan sigma C–C, seperti ditunjukkan pada Gambar 17.
 |
| Gambar 17. Tumpang tindih orbital hibrida sp2– sp2 membentuk ikatan-σ karbonkarbon. |
Pada masing-masing atom karbon masih tersisa satu orbital hibrida sp2 yang belum digunakan berikatan dengan orientasi tegak lurus terhadap bidang H–C–H. Kedua orbital hibrida sp2 ini,
kemudian bertumpang tindih lagi membentuk ikatan kedua. Ikatan ini
dinamakan ikatan pi (π). Jadi, ikatan rangkap dalam etilen dibangun oleh
ikatan sigma dan ikatan pi, seperti ditunjukkan pada Gambar 18 berikut.
b. Hibridisasi dalam Ikatan Rangkap Tiga
Senyawa karbon yang mengandung ikatan rangkap tiga cukup banyak. Salah satu contoh yang paling sederhana adalah etuna (C2H2) atau disebut asetilen. Menurut teori domain elektron, bentuk molekul asetilen adalah linear. Oleh karena itu, orbital-orbital dalam atom karbon membentuk orbital hibrida sp.
Untuk memahami ikatan dalam molekul asetilen dapat dijelaskan dalam dua tahap. Pertama terjadi tumpang tindih dua orbital sp dari masing-masing atom karbon untuk membentuk orbital ikatan sigma C–C, kemudian orbital hibrida sp yang satunya lagi bertumpang tindih dengan orbital 1s dari atom hidrogen membentuk dua ikatan sigma C–H, seperti ditunjukkan pada Gambar 19. berikut.
 |
| Gambar 19. Kerangka ikatan dalam asetilen. Orbital ikatan C–C hasil dari tumpang tindih dua orbital hibrida sp. Dua orbital ikatan C–H hasil dari tumpang tindih orbital sp dan 1s dari hidrogen. |
Dua orbital 2p sisa pada masing-masing atom karbon saling tegak lurus
terhadap sumbu H–C ≡ C–H, seperti ditunjukkan pada Gambar 19.
Kedua orbital ini dapat bertumpang tindih membentuk dua orbital ikatan pi. Jadi, dalam molekul asetilen ada lima ikatan, tiga ikatan sigma dan dua ikatan pi.
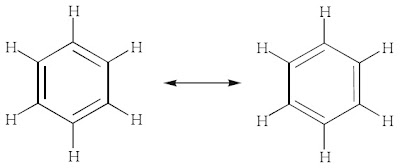
c. Hibridisasi dalam Molekul Benzena
Terdapat sejumlah molekul yang memiliki ikatan π (phi). Salah satu contoh yang penting adalah molekul benzena (C6H6). Molekul benzena secara prinsip memiliki dua bentuk resonansi yang dapat diungkapkan dalam bentuk hibrida resonansi, yaitu:
Bentuk molekul benzena adalah heksagonal datar, sedangkan struktur pada
setiap atom karbon dalam benzena adalah trigonal planar dengan sudut
ikatan 120° maka dapat diduga bahwa hibridisasi yang terjadi pada atom
karbon adalah sp2.
Orbital hibrida sp2 yang pertama digunakan berikatan dengan orbital 1s dari atom hidrogen. Dua orbital hibrida sp2 yang lain digunakan untuk berikatan dengan orbital sp2 dari atom-atom karbon yang berdampingan. Semua ikatan yang dibentuk adalah ikatan sigma, seperti ditunjukkan pada Gambar 20.
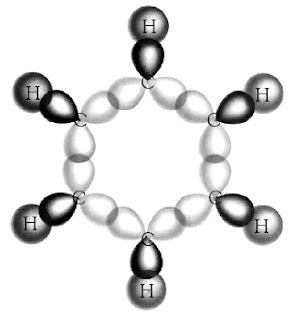 |
| Gambar 20. Tumpang tindih orbital hibrida sp2– sp2 dalam molekul benzena membentuk ikatan sigma. |
Setiap atom karbon memiliki orbital 2p sisa yang tegak lurus terhadap bidang heksagonal, seperti ditunjukkan pada Gambar 21.
Keenam orbital 2p tersebut bertumpang tindih membentuk tiga ikatan pi.
Ikatan pi ini tidak diasosiasikan dengan setiap pasang atom karbon
tertentu melainkan orbitalorbital tersebut membentuk orbital
terdelokalisasi.
 |
| Gambar 21. Tumpang tindih orbital 2p yang tidak digunakan dalam hibridisasi membentuk ikatan phi (Ikatan phi dalam benzena menjadikan elektron-elektron terdelokalisasi dalam molekul benzena). |
Terdapat tiga puluh elektron valensi dalam senyawa benzena. Sebanyak 24
elektron valensi menghuni 12 orbital ikatan sigma dan 6 elektron valensi
menghuni 3 orbital ikatan pi menghasilkan kerapatan muatan elektron
total, seperti ditunjukkan pada Gambar 21.
D. Gaya Antar Molekul
Gaya antar molekul adalah gaya aksi di antara molekul-molekul yang menimbulkan tarikan antarmolekul dengan berbagai tingkat kekuatan. Pada suhu tertentu, kekuatan tarikan antarmolekul menentukan wujud zat, yaitu gas, cair, atau padat.
Kekuatan gaya antar molekul lebih lemah dibandingkan ikatan kovalen maupun ikatan ion. Ikatan kimia dan gaya antarmolekul memiliki perbedaan. Ikatan kimia merupakan gaya tarik menarik di antara atom-atom yang berikatan, sedangkan gaya antar molekul merupakan gaya tarik menarik di antara molekul (perhatikan Gambar 22).
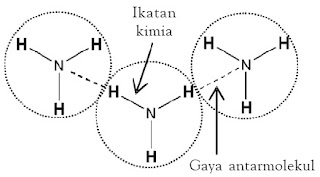 |
| Gambar 22. Gaya antar molekul adalah gaya yang lebih lemah dibandingkan ikatan kimia. |
Ada tiga jenis gaya antarmolekul, yaitu gaya dipol-dipol, gaya London,
dan ikatan hidrogen. Gaya dipol-dipol dan gaya London dapat dianggap
sebagai satu jenis gaya, yaitu gaya van der Waals.
4.1. Gaya Dipol-Dipol
Gaya dipol-dipol adalah gaya yang terjadi di antara molekul-molekul yang memiliki sebaran muatan tidak homogen, yakni molekul-molekul dipol atau molekul polar. Molekul-molekul polar memiliki dua kutub muatan yang berlawanan. Oleh karena itu, di antara molekul-molekulnya akan terjadi antaraksi yang disebabkan kedua kutub muatan yang dimilikinya.
Pada antaraksi dipol-dipol, ujung-ujung parsial positif suatu molekul mengadakan tarikan dengan ujung-ujung parsial negatif dari molekul lain yang mengakibatkan orientasi molekul-molekul sejajar, seperti ditunjukkan pada Gambar 23.
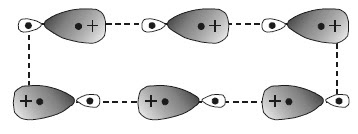 |
| Gambar 23. Gaya dipol-dipol permanen. |
Tarikan dipol-dipol mempengaruhi sifat-sifat fisik senyawa, seperti
titik leleh, kalor peleburan, titik didih, kalor penguapan, dan sifat
fisik lainnya.
Tabel 2. menunjukkan perbandingan sifat-sifat senyawa untuk massa molekul yang relatif sama dengan berbagai gaya antarmolekul.
Tabel 2. menunjukkan perbandingan sifat-sifat senyawa untuk massa molekul yang relatif sama dengan berbagai gaya antarmolekul.
Tabel 2. Sifat Fisika Molekul Hidrida Periode ke-4
Sifat-Sifat
Fisika
|
SiH4
|
PH3
|
H2S
|
Kepolaran
|
Nonpolar
|
Polar
|
Polar
|
Wujud
|
Gas
|
Gas
|
Gas
|
Massa
molekul
|
32,09
|
34,0
|
34,08
|
Titik
leleh (°C)
|
–185
|
–134
|
–85,6
|
Titik
didih (°C)
|
–111
|
–87,8
|
–60,8
|
Kalor
lebur (kJ mol–1)
|
0,66
|
1,13
|
2,38
|
Kalor
uap (kJ mol–1)
|
13
|
14,6
|
18,7
|
Momen
dipol
|
0
|
0,55
|
1,10
|
Sumber: Chemistry with Inorganic Qualitative Analysis, 1989
|
|||
Simak sifat-sifat fisika SiH4,
PH3, dan H2S pada Tabel 2. tersebut. Senyawa-senyawa tersebut memiliki massa molekul relatif yang sama. Molekul SiH4 bersifat
nonpolar, memiliki titik leleh dan titik didih paling tinggi serta
kalor peleburan dan kalor penguapan juga rendah. Molekul H2S memiliki momen dipol dua kali dari PH3 dan sesuai ramalan bahwa sifat-sifat fisika H2S lebih tinggi PH3 dan SiH4.
Mengapa molekul polar memiliki sifat-sifat fisika yang relatif lebih tinggi dibandingkan dengan molekul non polar untuk massa yang tidak berbeda jauh? Sebagai contoh, tinjau titik didih. Titik didih berhubungan dengan energi yang diperlukan untuk memutuskan gaya antaraksi antarmolekul (bukan memutuskan ikatan kimia antar atom). Semakin kuat gaya antar aksi antar molekul, semakin besar energi yang diperlukan untuk memutuskannya. Dengan kata lain, semakin tinggi titik didihnya. Hal ini menunjukkan bahwa dalam molekul polar terjadi gaya antaraksi yang relatif lebih kuat dibandingkan dalam molekul nonpolar.
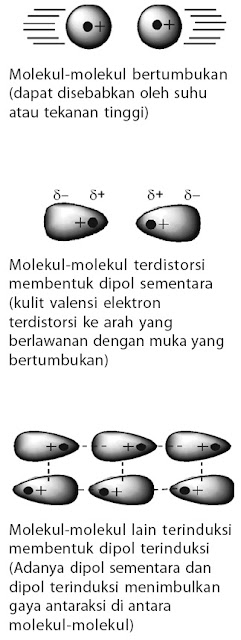
4.2. Gaya London
Gaya London adalah gaya yang terjadi pada atom atau molekul, baik polar maupun nonpolar. Gaya London atau disebut juga gaya dispersi, yaitu gaya yang timbul akibat dari pergeseran sementara (dipol sementara) muatan elektron dalam molekul homogen. Dalam ungkapan lain, dapat dikatakan bahwa gaya London terjadi akibat kebolehpolaran atau distorsi “awan elektron” dari suatu molekul membentuk dipol sementara (molekul polar bersifat dipol permanen).
Mengapa awan elektron dapat terdistorsi? Hal ini dapat dijelaskan sebagai berikut.
- Pada sekumpulan besar molekul, setiap saat selalu terjadi tumbukan antar molekul, tumbukan ini menimbulkan dipol sementara membentuk muatan parsial positif pada salah satu ujung molekul dan muatan parsial negatif pada ujung yang lain (terdistorsi).
- Molekul-molekul yang terdistorsi selanjutnya menginduksi molekul lain membentuk dipol terinduksi.
- Akibat terbentuk dipol sementara pada sejumlah molekul yang bertumbukan dan menginduksi sejumlah molekul lain membentuk dipol terinduksi, menimbulkan gaya tarik-menarik di antara molekul-molekul tersebut. Gaya tarik-menarik seperti ini dinamakan gaya London.
- Gejala tersebut berlangsung secara terus menerus dan berimbas kepada molekul-molekul lain sehingga terjadi gaya London di antara molekul-molekul yang ada.
Dengan demikian, gaya London adalah gaya antar aksi antar atom atau
molekul yang memiliki dipol sementara dengan jarak yang sangat
berdekatan satu sama lain. Kekuatan gaya London dipengaruhi oleh ukuran,
bentuk molekul, dan kemudahan distorsi dari awan elektron. Sentuhan di
antara atom atau molekul dengan luas permukaan sentuhan besar
menghasilkan peluang lebih besar membentuk dipol sementara dibandingkan
bidang sentuh yang relatif kecil. Semakin besar luas permukaan bidang
sentuh molekul, semakin besar peluang terjadinya dipol sementara.
Bagaimanakah bentuk molekul yang memiliki peluang lebih besar terjadi gaya London? Untuk menjawab pertanyaan ini, simak Tabel 3. berikut yang menyajikan hubungan bentuk molekul dan peluang terjadinya gaya London.
Tabel 3. Titik Didih Beberapa Senyawa Nonpolar
Keadaan
|
Nama Senyawa
|
Rumus Struktur
|
Titik Didih
(°C)
|
Massa
molekul
sama,
bentuk
molekul
yang
sperik
(bulat)
menurun
|
Neopentana
|
9,5
|
|
Isopentana
|
28
|
||
n–pentana
|
CH3CH2CH2CH2CH3
|
36
|
|
Bentuk
molekul
serupa,
massa
molekul
meningkat
|
Metana
|
CH4
|
–161
|
Etana
|
CH3CH3
|
–88,6
|
|
n–propana
|
CH3CH2CH3
|
–44,5
|
|
n–butana
|
CH3CH2CH2CH3
|
–0,5
|
|
Sumber:
Chemistry with Inorganic Qualitative Analysis, 1989
|
|||
Apakah yang dapat Anda simpulkan dari data tersebut? Perhatikan tingkat
speritas molekul. Oleh karena neopentana lebih sperik dari molekul yang
lain maka bidang sentuhnya paling kecil sehingga peluang terciptanya
gaya London relatif kecil. Akibatnya, gaya tarik antarmolekul lemah. Hal
ini ditunjukkan oleh titik didih yang relatif rendah.
Di antara bentuk molekul yang serupa, gaya London meningkat dengan bertambahnya jumlah elektron atau dengan bertambahnya massa molekul. Butana memiliki jumlah elektron lebih rumit dibandingkan molekul lain sehingga gaya Londonnya lebih besar. Ini ditunjukkan oleh titik didihnya yang paling tinggi.
4.3. Ikatan Hidrogen
Senyawa yang mengandung atom hidrogen dan atom yang memiliki keelektronegatifan tinggi, seperti fluorin, klorin, nitrogen, dan oksigen dapat membentuk senyawa polar, mengapa? Pada molekul polar, pasangan elektron ikatan yang digunakan bersama lebih tertarik ke arah atom dengan keelektronegatifan tinggi. Akibatnya, atom hidrogen menjadi lebih bermuatan positif. Akibat dari gejala tersebut, atom hidrogen dalam molekul polar seolah-olah berada di antara atom-atom elektronegatif.
Apa yang akan terjadi jika atom hidrogen yang bermuatan parsial positif berantaraksi dengan atom-atom pada molekul lain yang memiliki muatan parsial negatif dan memiliki pasangan elektron bebas. Anda pasti menduga akan terjadi antaraksi di antara molekul-molekul tersebut sebab molekulnya polar.
Jika hanya antaraksi akibat kepolaran maka molekul H2S dan H2O memiliki sifat fisik yang relatif sama sebab keduanya polar. Akan tetapi, fakta menunjukkan bahwa pada suhu kamar, H2O berwujud cair dan H2S berwujud gas. Apa yang salah dengan konsep kepolaran? Konsep kepolaran tidak salah, tetapi ada faktor lain selain kepolaran. Berdasarkan hasil pengamatan, dalam senyawa-senyawa polar yang mengandung atom hidrogen ada antaraksi yang lebih kuat dibandingkan antaraksi dipol maupun gaya London. Antaraksi ini dinamakan ikatan hidrogen (perhatikan Gambar 24).
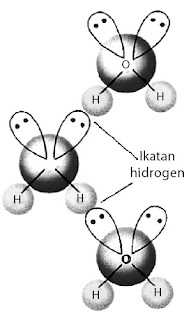 |
| Gambar 24. Ikatan hidrogen pada air. |
Ikatan hidrogen terbentuk pada senyawa-senyawa polar yang mengandung
atom H dan atom yang memiliki keelektronegatifan tinggi, seperti F, O,
N, dan Cl. Atom-atom yang memiliki keelektronegatifan tinggi akan
menarik pasangan elektron ikatan lebih kuat sehingga kulit valensi
elektron pada atom hidrogen seperti terkelupas, dan inti atom hidrogen
yang bermuatan positif seolah-olah berada di permukaan molekul. Semakin
tinggi skala keelektronegatifan atom yang mengikat atom hidrogen,
semakin besar peluangnya untuk membentuk ikatan hidrogen.
Contoh :
Belerang dan oksigen memiliki keelektronegatifan S = 2,5 dan O = 3,5. Oleh karena keelektronegatifan atom oksigen lebih tinggi maka peluang terjadinya ikatan hidrogen sangat besar. Hal ini terbukti dengan tingginya titik leleh dan titik didih H2O dibandingkan H2S. Dengan hadirnya ikatan hidrogen dalam suatu senyawa menimbulkan pengaruh terhadap sifat-sifat fisik senyawa tersebut, seperti ditunjukkan oleh senyawa hidrida non logam pada Tabel 4.
Tabel 4 Sifat Fisik Senyawa Hidrida Non logam
Sifat-Sifat
|
NH3
|
PH3
|
H2O
|
H2S
|
HF
|
HCl
|
Kepolaran
|
Polar
|
Polar
|
Polar
|
Polar
|
Polar
|
Polar
|
Wujud
|
Gas
|
Gas
|
Cair
|
Gas
|
Asap
|
Gas
|
Massa
molekul
|
17,03
|
34,0
|
18,02
|
34,08
|
20,01
|
36,46
|
Titik
leleh°C
|
–78
|
–134
|
0,0
|
–85,6
|
–83,0
|
–114
|
Titik
didih°C
|
–33
|
–87,8
|
100,0
|
–60,8
|
19,5
|
–84,9
|
Kalor
lebur(kJ mol–1)
|
5,52
|
1,13
|
6,02
|
2,38
|
4,56
|
1,99
|
Kalor
uap(kJ mol–1)
|
23,3
|
14,6
|
40,7
|
18,7
|
25,6
|
16,1
|
Tabel 4. menunjukkan sifat-sifat fisik senyawa hidrida periode ke- 2 dan periode ke-3 dalam tabel periodik. Periode ke-2, yaitu NH3,
H2O, dan HF, sedangkan periode ke-3, yaitu PH3,
H2S, dan HCl. Pasangan seperti NH3–PH3;
H2O–H2S; dan HF–HCl berasal dari golongan yang sama dalam tabel periodik. Dari pasangan tersebut, NH3,
H2O, dan HF memiliki massa molekul lebih kecil, tetapi
memiliki titik leleh dan titik didih lebih tinggi dibandingkan senyawa
yang segolongan (lihat grafik pada Gambar 25).
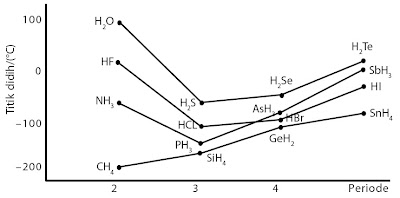 |
| Gambar 25. Kurva titik didih senyawa hidrida non logam. |
Hal ini menunjukkan adanya ikatan hidrogen pada molekul NH3,
H2O, dan HF, sedangkan pada molekul hidrida di bawahnya tidak terjadi ikatan hidrogen.
Ada dua macam ikatan hidrogen, yaitu ikatan hidrogen antarmolekul
(intermolecule) dan ikatan hidrogen dalam molekul itu sendiri
(intramolecule) (perhatikan Gambar 26).
Ikatan hidrogen antarmolekul adalah ikatan antara dua atau lebih
molekul, baik molekul yang sama maupun molekul berbeda. Misalnya,
antarmolekul H2O,
NH3, CH3CH2OH, HF, atau SiF4. Ikatan hidrogen dalam molekul adalah ikatan antara dua gugus atom dalam suatu molekul, misalnya dalam asam benzoat.
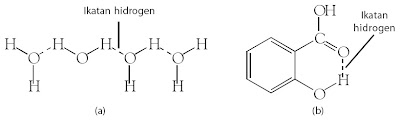 |
| Gambar 26. (a) Ikatan hidrogen dapat berupa ikatan antarmolekul (b) Ikatan hidrogen dalam molekul. |
Ikatan Hidrogen pada DNA
DNA, pembawa informasi genetika (memungkinkan informasi genetika terwariskan) adalah molekul yang berukuran sangat besar, terdiri atas dua utas rantai yang saling berhadapan membentuk rantai ganda berpilin. Rantai ganda berpilin ini terbentuk karena adanya ikatan hidrogen antara kedua utas rantai penyusun DNA. Oleh karena kekuatan ikatan hidrogen lebih kecil dari ikatan kovalen atom-atom penyusun rantai maka kedua utas rantai DNA dapat dipisahkan dan mengalami replikasi (penggandaan DNA).
DNA, pembawa informasi genetika (memungkinkan informasi genetika terwariskan) adalah molekul yang berukuran sangat besar, terdiri atas dua utas rantai yang saling berhadapan membentuk rantai ganda berpilin. Rantai ganda berpilin ini terbentuk karena adanya ikatan hidrogen antara kedua utas rantai penyusun DNA. Oleh karena kekuatan ikatan hidrogen lebih kecil dari ikatan kovalen atom-atom penyusun rantai maka kedua utas rantai DNA dapat dipisahkan dan mengalami replikasi (penggandaan DNA).
Contoh Soal Gaya Antar Molekul :
Di antara senyawa berikut, manakah yang berpotensi memiliki ikatan hidrogen?
a. HBr
b. CH4
c. CH3COOH
d. CH3OHJawaban :
Syarat utama adanya ikatan hidrogen bahwa senyawa harus mengandung atom hidrogen. Kedua, atom yang mengikat hidrogen memiliki keelektronegatifan tinggi. Semua senyawa yang ditanyakan mengandung atom hidrogen, tetapi di antara senyawa itu, yang memiliki kelektronegatifan paling tinggi adalah O. Dengan demikian, senyawa yang berpotensi memiliki ikatan hidrogen adalah CH3COOH dan CH3OH. Ikatan hidrogen yang terjadi adalah antarmolekul (intermolecular).
Rangkuman :
- Bentuk molekul ditentukan oleh jumlah ikatan setiap atom dan sudut ikatan di antara atom-atom.
- Ada tujuh macam bentuk dasar molekul, yaitu linear, trigonal planar, bujur sangkar, tetrahedral, limas segitiga, trigonal bipiramidal, dan oktahedral.
- Teori domain elektron dapat dipakai untuk meramalkan bentuk molekul berdasarkan pada tolakan antara pasangan elektron dalam kulit valensi atom pusat.
- Jika dalam atom pusat terdapat pasangan elektron bebas sebanyak satu atau lebih, bentuk molekul yang dihasilkan dapat berubah dari bentuk dasarnya sebab pasangan elektron bebas memiliki kekuatan tolakan lebih kuat pasangan elektron lain .
- Urutan kekuatan tolakan di antara pasangan elektron, yaitu PEB–PEB > PEB–PEI > PEI–PEI
- Teori ikatan valensi dapat digunakan untuk mengevaluasi bentuk molekul berdasarkan pendekatan hibridisasi orbital atom.
- Hibridisasi adalah pencampuran (kombinasi) orbital-orbital atom membentuk orbital hibrida dengan tingkat energi berada di antara orbital-orbital atom yang dihibridisasikannya.
- Jenis hibridisasi pada kulit valensi atom pusat dapat ditentukan dari bentuk molekul. Hibridisasi sp terjadi pada molekul linear, sp2 pada molekul trigonal planar, sp3 pada molekul tetrahedral, dsp3 pada molekul dwilimas segitiga, dan d2sp3 pada molekul tetrahedral.
- Ikatan yang terjadi di antara orbital hibrida dengan orbital atom maupun orbital hibrida yang lain dinamakan ikatan sigma. Orbital atom yang tidak digunakan dalam hibridisasi jika digunakan untuk berikatan akan membentuk ikatan pi.
- Wujud suatu materi, seperti gas, cair, dan padat ditentukan oleh gaya antar molekul. Ada tiga jenis gaya, yaitu gaya dipol-dipol, gaya London, dan ikatan hidrogen. Gaya dipol-dipol dan gaya London tergolong gaya van der Waals.
- Gaya dipol-dipol adalah antar aksi antara molekul-molekul yang memiliki kepolaran. Kepolaran dalam molekul terjadi akibat perbedaan skala keelektronegatifan atom yang membentuk molekul.
- Gaya dispersi London yang disebabkan oleh adanya dipol sementara sebagai akibat tumbukan antaratom atau molekul yang berdekatan.
- Gaya dipol yang lebih kuat terjadi pada molekul yang mengandung atom hidrogen terikat pada unsur dengan keelektronegatifan tinggi, seperti nitrogen, oksigen, atau fluorin. Gaya dipol yang dihasilkan dinamakan ikatan hidrogen.
Referensi :
http://perpustakaancyber.blogspot.com
http://perpustakaancyber.blogspot.com
















No comments:
Post a Comment