A.
PENGERTIAN HUKUM HOOKE DAN ELASTISITAS
Hukum Hooke dan elastisitas merupakan dua
istilah yang saling berkaitan. Untuk memahami arti kata elastisitas, banyak
orang menganalogikan istilah tersebut dengan benda-benda yang terbuat dari
karet, meskipun pada dasarnya tidak semua benda dengan bahan dasar karet
bersifat elastis. Kita ambil dua contoh karet gelang dan peren karet. Jika karet
gelang tersebut ditarik, maka panjangnya akan terus bertambah sampai batas
tertentu. Kemudian, apabila tarikan dilepaskan
panjang karet gelang akan kembali seperti semula. Berbeda halnya dengan permen
karet, Jika ditarik panjangnya akan terus bertambah sampai batas tertentu tapi
apabila tarikan dilepaskan panjang permen karet tidak akan kembali seperti semula. Hal ini dapat terjadi karena karet
gelang bersifat elastis sedangkan permen
karet bersifat plastis. Namun, apabila karet gelang ditarik terus menerus
adakalanya bentuk kareng gelang tidak kembali seperti semula yang artinya sifat
elastisnya telah hilang. Sehingga diperlu tingkat kejelian yang tinggi untuk
menggolongkan mana benda yang bersifat elastis dan plastis.
Jadi,
dapat disimpulkan bahwa elastisitas adalah kemampuan suatu
benda untuk kembali ke bentuk awal setelah gaya pada benda tersebut
dihilangkan. Keadaan dimana suatu benda tidak dapat lagi kembali ke bentuk
semula akibat gaya yang diberikan terhadap benda terlalu besar disebut sebagai batas
elastis. Sedangkan hukum Hooke merupakan gagasan yang diperkenalkan oleh
Robert Hooke yang menyelidiki hubungan antar gaya yang bekerja pada sebuah pegas/benda elastis lainnya agar benda
tersebut bisa kembali ke bentuk semua atau tidak melampaui batas
elastisitasnya.
Dengan demikian, dapat disimpulkan bahwa Hukum
Hooke mengkaji jumlah gaya maksimum yang dapat diberikan pada sebuah benda yang
sifatnya elastis (seringnya pegas) agar
tidak melwati batas elastisnya dan menghilangkan sifat elastis benda tersebut.
B. KONSEP HUKUM HOOKE DAN ELASTISITAS
Bunyi Hukum Hooke ialah “Jika gaya tarik yang diberikan pada sebuah pegas tidak melampaui batas elastis bahan maka pertambahan panjang pegas berbanding lurus/sebanding dengan gaya tariknya”.
Jika gaya yang diberikan melampaui batas
elastisitas, maka benda tidak dapat kembali ke bentuk semula dan apabila gaya
yang diberikan jumlahnya terus bertambah maka benda dapat rusak. Dengan kata
lain, hukum Hooke hanya berlaku hingga batas
elastisitas.
Dari gagasan tersebut dapat disimpulkan bahwa
konsep hukum Hooke ini menjelaskan mengenai hubungan antara gaya yang diberikan
pada sebuah pegas ditinjau dari pertambahan panjang yang dialami oleh pegas
tersebut. Besarnya perbandingan antara gaya dengan pertambahan panjang pegas
adalah konstan. Fenomena ini dapat lebih mudah dipahami dengan memperhatikan
gambar grafik berikut ini.
Gambar 1, menjelaskan bahwasanya jika pegas
ditarik ke kanan
maka pegas akan
meregang dan bertambah
panjang. Jika gaya tarik yang diberikan pada pegas tidak terlalu
besar, maka pertambahan panjang pegas sebanding dengan besarnya gaya tarik. Dengan
kata lain, semakin besar gaya tarik, semakin besar pertambahan panjang pegas.
Pada Gambar 2, digambarkan bahwa kemiringan
grafik sama besar yang menunjukkan perbandingan besar gaya tarik terhadap
pertambahan panjang pegas bernilai konstan. Hal ini menggambarkan sifat
kekakuan dari sebuah pegas yang dikenal sebagai ketetapan pegas. Secara
matematis hukum Hooke
dapat dituliskan sebagai berikut.
Keterangan:
F = Gaya luar yang diberikan (N)
k
= Konstanta pegas (N/m)
Δx = Pertanbahan panjang pegas dari posisi
normalnya (m)
Artikel Penunjang : Hukum Perbandingan Tetap (Hukum Proust)
C. BESARAN
DAN RUMUS DALAM HUKUM HOOKE DAN ELASTISITAS
1. Tegangan
Tegangan merupakan keadaan dimana sebuah benda
mengalami pertambahan panjang ketika sebuah benda diberi gaya pada salah satu
ujungnya sedangkan ujung lainnya ditahan. Contohnya, misal seutas kawat dengan
luas penampang x m2, dengan panjang mula-mula x meter ditarik dengan
gaya sebesar N pada salah satu ujungnya sedangkan pada ujung yang lain ditahan
maka kawat akan mengalami pertambahan panjang sebesar x meter. Fenomena ini mengambarkan suatu tegangan yang
mana dalam fisika disimbolkan dengan σ dan secara matematis dapat ditulis
seperti berikut ini.
Keterangan:
F = Gaya (N)
A = Luas penampang (m2)
σ = Tegangan (N/ m2 atau Pa)
2. Regangan
Regangan merupakan perbandingan antara pertambahan
panjang kawat dalam x meter dengan panjang
awal kawat dalam x meter. Regangan dapat terjadi dikarenakan gaya yang
diberikan pada benda ataupun kawat tersebut dihilangkan, sehingga kawat kembali
ke bentuk awal.
Hubungan ini secara matematis dapat dituliskan
seperti dibawah ini.
Keterangan:
e =
Regangan
ΔL = Pertambahan panjang (m)
Lo = Panjang mula-mula (m)
Sesuai dengan persamaan di atas, regangan (e) tidak
memiliki satuan dikarenakan pertambahan
panjang (ΔL) dan panjang
awal (Lo) adalah
besaran dengan satuan yang sama
3. Modulus
Elastisitas (Modulus Young)
Dalam fisika, modulus elastisitas disimbolkan
dengan E. Modulus elastisitas menggambarkan perbandingan antara tegangan dengan
regangan yang dialami bahan. Dengan kata lain, modulus elastis sebanding dengan
tegangan dan berbanding terbalik regangan.
Keterangan:
E = Modulus elastisitas (N/m)
e = Regangan
σ = Tegangan (N/ m2
atau Pa)
4. Mampatan
Mampatan merupakan suatu keadaan yang hampir serupa
dengan regangan. Perbedaannya terletak pada arah perpindahan molekul benda
setelah diberi gaya. Berbeda halnya pada regangan dimana molekul benda akan
terdorong keluar setelah diberi gaya. Pada mampatan, setelah diberi gaya,
molekul benda akan terdorong ke dalam (memampat).
5. Hubungan
Antara Gaya Tarik dan Modulus Elastisitas
Jika ditulis secara matematis, hubungan antara gaya
tarik dan modulus elastisitas meliputi:
Keterangan:
F = Gaya (N)
E = Modulus elastisitas (N/m)
e = Regangan
σ = Tegangan (N/ m2
atau Pa)
A = Luas penampang (m2)
E = Modulus elastisitas (N/m)
ΔL = Pertambahan panjang (m)
Lo = Panjang mula-mula (m)
6. Hukum
Hooke
Hukum Hooke menyatakan bahwa “jika gaya tari tidak melampaui batas elastis
pegas, maka pertambahan panjang pegas berbanding lurus dengan gaya tariknya”. Secara
matematis ditulis sebagai berikut.
Keterangan:
F = Gaya luar yang diberikan (N)
k
= Konstanta pegas (N/m)
Δx = Pertanbahan panjang pegas dari posisi
normalnya (m)
Hukum Hooke untuk Susuna Pegas
6a. Susunan Seri
Apabila dua buah pegas yang
memiliki tetapan pegas yang sama dirangkaikan secara seri, maka panjang pegas
menjadi 2x. Oleh karena itu, persamaan pegasnya yaitu:
Keterangan:
Ks = Persamaan pegas
k
= Konstanta pegas (N/m)
Sedangkan persamaan untuk n pegas yang
tetapannya dan disusun seri ditulis seperti berikut ini.
Keterangan:
n = Jumlah pegas
6b. Susunan Paralel
Apabila pegas disusun
secara paralel, panjang pegas akan tetap seperti semula, sedangkan luas
penampangnya menjadi lebih 2x dari semula jika pegas disusun 2 buah. Adapun
persamaan pegas untuk dua pegas yang disusun secara paralel, yaitu:
Keterangan:
Kp = Persamaan pegas susunan paralel
k
= Konstanta pegas (N/m)
Sedangkan persamaan untuk n pegas yang
tetapannya sama dan disusun secara paralel, akan dihasilkan pegas yang lebih
kuat karena tetapan pegasnya menjadi
lebih besar. Persamaan pegasnya dapat ditulis sebagai berikut.
Keterangan:
n = Jumlah pegas
D.
APLIKASI HUKUM HOOKE
Dalam pengaplikasian hukum Hooke sangat berkaitan erat dengan
benda benda yang
prinsip kerjanya menggunakan
pegas dan yang bersifat elastis. Prinsip hukum Hooke telah diterapkan
pada beberapa benda-benda berikut ini.
- Mikroskop yang berfungsi untuk melihat jasad-jasad renik yang sangat kecil yang tidak dapat dilihat oleh mata telanjang
- Teleskop yang berfungsi untuk melihat benda-beda yang letaknya jauh agar tampak dekat, seperti benda luar angkasa
- Alat pengukur percepatan gravitasi bumi
- Jam yang menggunakan peer sebagaipengatur waktu
- Jam kasa atau kronometer yang dimanfaatkan untuk menentukan garis atau kedudukan kapal yang berada di laut
- Sambungan tongkat-tongkat persneling kendaraan baik sepeda motor maupun mobil
- Ayunan pegas
- Beberapa benda yang telah disebutkan diatas memiliki peranan penting dalam kehidupan manusia. Dengan kata lain, gagasan Hooke memberi dampak positif terhadap kualitas hidup maunsia.
artikel ini disalin lengkap dari: http://www.softilmu.com/2015/12/Pengertian-Konsep-Rumus-Besaran-Aplikasi-Hukum-Hooke-Adalah.html
halaman utama website: http://www.softilmu.com/
jika mencari artikel yang lebih menarik lagi, kunjungi halaman utama website tersebut. Terimakasih!























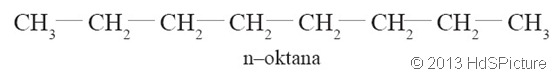
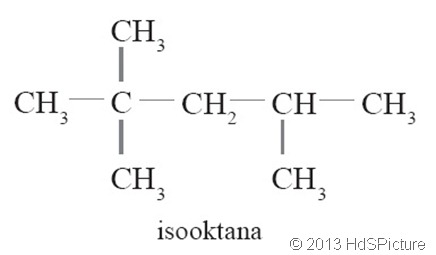
 Sikloalkana
juga dikenal dengan nama naptena. Naptena adalah senyawa hidrokarbon
tersaturasi yang mempunyai satu atau lebih ikatan rangkap pada
karbonnya. Naptena memiliki rumus umum CnH2n dan mempunyai ciri-ciri mirip alkana tetapi mempunyai titik didih yang lebih tinggi.
Sikloalkana
juga dikenal dengan nama naptena. Naptena adalah senyawa hidrokarbon
tersaturasi yang mempunyai satu atau lebih ikatan rangkap pada
karbonnya. Naptena memiliki rumus umum CnH2n dan mempunyai ciri-ciri mirip alkana tetapi mempunyai titik didih yang lebih tinggi.