Baterai adalah salah satu sumber listrik
yang punya banyak manfaat bagi manusia. Mulai dari berai senter,
baterai jam, hingga baterai gadget kesayangan kita. Baterai yang kita
gunakan pada senter atau jam tangan atau sering kita bilang dengan “batu
baterai” ternyata terbuat dari sel kering yang merupakan aplikasi nyata
dari sel Galvani. Nah, apa itu sel galvani?
Temukan jawabannya pada sajian berikut
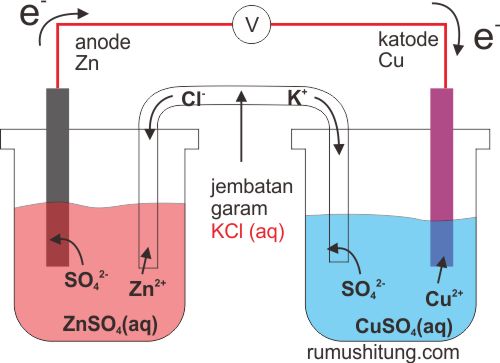
Jika logam seng (Zn) dicelupkan sebagian (ada kontak) dengan ZnSO4 (larutan garam dari Zn) dihubungkan dengan logam tembaga Cu yang dicelupkan sebagian ke dalam larutan CuSO4 (larutan garam dari Cu) melalui sebuah kawat penghantar dan diantara kedua larutan tersebut dihubungkan dengan jembatan garam yang berisi larutan lektrolit maka akan terjadi beda potensial. Itulah definisi dari sel galvani. Pertanyaannya? dari mana munculnya beda potensial tersebut?
artikel ini disalin lengkap dari: http://rumushitung.com/2014/06/12/sel-galvani-dan-aplikasinya/
halaman utama website: http://rumushitung.com/
jika mencari artikel yang lebih menarik lagi, kunjungi halaman utama website tersebut. Terimakasih!
Temukan jawabannya pada sajian berikut
Apa itu Sel Galvani?
Sel Galvani
atau yang sering disebut juga dengan nama Sel Volta merupakan bagian
dari sel elektrokimia. Ada dua macam sel elektrokimia yaitu sel galvani
(volta) dan sel elektrolisis. Sel galvani adalah rangkaian sel
elektrokimia yang terdiri dari dua logam disambungkan dengan jembatan
garam yang memanfaatkan reaksi redoks dari kedua logam tersebut untuk menghasilkan arus listrik. Pada akhir abad kke-18 ilmuwan italia bernama Luigi Galvani
menemukan kejadian yang cukup menarik. Seekor katak mati ketika di
kakinya masing masing diletakkan logam berbeda (seng dan tembaga) secara
bersamaan ternyata kaki katak yang sudah mati tersebut bisa bergerak.
Sejak itulah muncul istilah galvanism.
Sel galvani terdiri dari dua elektroda
logam yang masing-masing dicelupkan dalam larutan garam dari
masing-masing logam tersebut. Kita simak ilustrasi berikut

Jika logam seng (Zn) dicelupkan sebagian (ada kontak) dengan ZnSO4 (larutan garam dari Zn) dihubungkan dengan logam tembaga Cu yang dicelupkan sebagian ke dalam larutan CuSO4 (larutan garam dari Cu) melalui sebuah kawat penghantar dan diantara kedua larutan tersebut dihubungkan dengan jembatan garam yang berisi larutan lektrolit maka akan terjadi beda potensial. Itulah definisi dari sel galvani. Pertanyaannya? dari mana munculnya beda potensial tersebut?
Ketika logam Zn dihubungkan dengan Cu terjadi reaksi redoks, Zn
melepaskan elektron yang akan menglir ke katode Cu. Katode Cu
berhubungan langsung dengan ion Cu2+ yang dihasilkan dari ionisasi CuSO4
->Cu2+ + SO42-. Elektron yang berasal dari Zn akan mereduksi ion
Cu2+ menjadi Cu. Di sisi lain, karena ion Cu2+ semakin berkurang maka
akan kelebihan ion SO42-, nah ion ini akan dialirkan melalui jembatan
garam yang berisikan larutan elektrolit guna mengimbangi kelebihan ion
Zn3+ yang terdapat pada larutan anode. Proses tersebut akan membantu
kelitrikan setangah sel tetap netral. Menurut konvensi, dalam sel
volta, bagian anode (bagian yang mengalami oksidasi) disebut elektrode
negatif dan katodi disebut elektrode positif. Jadi
[su_pullquote]Anoda adalah elektroda tempat terjadinya oksidasi (melepas elektron)
Katoda adalah tempat terjadinya reduksi (menerima elektron)[/su_pullquote]
Aplikasi Sel Galvani
Sel galvani banyak diaplikasikan untuk
membuat berbagai sumber energi listrik yang multiguna seperti sel kering
pada baterai, sel nikel kadmium, baterai perak oksida, baterai merkuri,
dan sel aki.
a. Sel Kering (Baterai Kering)
Sel ini terdiri dari sebuk grafit,
salmiak dan batu kawi (kering = tidak basah). Sel ini banyak digunakan
sebagai sumber energi untuuk jam dinding, radio, lampu senter,
microphone, dan sebagainya. bagianluar sel ini dibuat dari bahan seng
yang berperan sebagai anode yang tampak mengkilap dibagian bawah sebagai
kutub negatif baterai. Ujung positif baterai (katode) terbuat dari
grafit yang dibungkus oleh pasta yang terbuat dari campuran serbuk
grafit (C), MnO2, dan NH4Cl. Sel baterai ini dapat menghasilkan
potensial sekitar 1,5 volt. Salah satu keuntungan dari sel kering ini
adalah biaya pembuatannya yang relatif murah dan jarang terjadi
kebocoran. Kelemahan dari aplikasi sel galvai ini adalah ia tida bisa
diisi ulang (rechargeable).
Sobat pasti kenal juga dengan namanya bateri alkali. Baterai alkali
adalah jenis sel kering yang menggunakan Zn dan MnO2 sebagai pereaksi
dalam kondisi basa (KOH). Voltase yang dihasilkan bisa mencapai 1,54
Volt. Harganya memang lebih mahal tapi sel bateri alkali punya waktu
hidup lebih lama.
b. Sel Nikad (Nikel Kadmium)
Aplikasi sel galvani lainnya adalah sel
nikel-kadmium atau sering disebut sel nikad. Sel ini termasuk baterai
yang bisa diisi ulang. Potensial yang dihasilkan sekitar 1,4 Volt. Sel
nikad sudah banyak digunakan untuk mentenagai berbagai barang
elektronik.
c. Baterai Merkurium
Sobat pernah melihat batu baterai jam
atau kalkulator yang bentuknya roda pipih berwarna perak? Itu adalah
baterai merkurium. Bateri ini adalah bateri ukuran mini pertama yang
diproduksi secara komersial pada tahun 1940-an. Anode dari sel galbani
ini berupa logam seng dan katodenya berupa merkurium (II) oksidad (HgO).
Baterai ini cenderung menghasilkan potensial yang stabil di angka 1,35
volt.
d. Baterai Perak Oksida
Baterai jenis ini menggunakan seng
sebagai anode dan Ag2O sebagai katode serta elektrolit basa. Voltase
yang dihasilkan cukup besar di angka 1,54 Volt.
e. Sel Aki
Sel aki terdiri dari timbal (Pb) sebagai
anode, PbO2 sebagai katode, dan elektrolit asam H2SO4. Sel jenis ini
termasuk sel sekunder karena zat-zat hasil reaksi dapa diubah menjadi
zat-zat semula (dikembalikan ke zat sebelum reaksi. Sel aki merupakan
sel galvani yag disusun secara seri sehingga bisa menghasilkan tegangan
yang lebih besar tergantung berapa susunan serinya. Jika sobat punya
sebuah sel aki 10 volt maka ia bisa tersusun oleh 5 buah sel aki 2 volt
yang disusun seri.
artikel ini disalin lengkap dari: http://rumushitung.com/2014/06/12/sel-galvani-dan-aplikasinya/
halaman utama website: http://rumushitung.com/
jika mencari artikel yang lebih menarik lagi, kunjungi halaman utama website tersebut. Terimakasih!

No comments:
Post a Comment