Atom merupakan puing terkecil dari suatu
zat yang memiliki sifat tidak bisa di bagi lagi. Pendapat seperti ini
ternyata tidak sepenuhnya benar. Apa alasannya? Pembuktian bahwa atom
bukan merupakan bagian terkecil dari suatu zat atau materi ditandai
dengan ditemukannya elektron oleh Sir John Joseph Thomson. Pembuktian
ini semakin menguat ketika imuwan berkebangsaan inggris Ernest
Rutherford berhasil menemukan bahwa inti atom masih tersusun dari bagian
yang lebih kecil berupa proton dan neutron. Elektron, proton, dan
neutron menjadi partikel dasar yang menyusun sebuah atom.
Lalu apa sebenarnya yang dimaksud dengan elektron, proton, dan neturon? Simak uraiannya di bawah ini.
Ketika diberikan pengaruh medan magnet atau medan listrik ternyata sinar tersebut membelok ke arah kutub positif
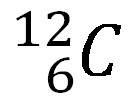
12 adalah nomor massa dan 6 adalah nomor atom
Yang perlu sobat ingat adalah dalam menentukan jumlah partikel dasar penyusun atom adalah:
2. Tentukan jumlah proton, elektron, dan netutron dari atom dan ion di tabel berikut (sobat bisa menggunakan bantuan tabel periodik)
artikel ini disalin lengkap dari: http://rumushitung.com/2015/11/23/partikel-dasar-penyusun-atom-kimia-x/
halaman utama website: http://rumushitung.com/
jika mencari artikel yang lebih menarik lagi, kunjungi halaman utama website tersebut. Terimakasih!
Lalu apa sebenarnya yang dimaksud dengan elektron, proton, dan neturon? Simak uraiannya di bawah ini.
Elektron
Di akhir tahun 1800-an tepatnya pada
tahun 1897, seorang ilmuwan berkebangsaan inggris bernama Sir John
Joseph Thomson atau yang sering sobat sebut dengan J.J. Thomson berhasil
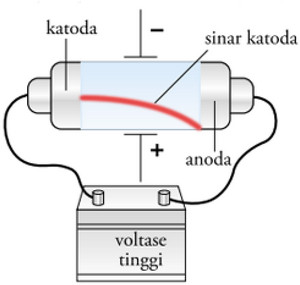
menemukan elektron. Ia melakukan pengamatan terhadap pelat katoda dan
anoda yang ditempatkan dalam tabung hampa udara yang dialiri arus
listrik tegangan tinggi. Dari percobaan tersebut ia menemukan bahwa
pelat katoda atau pelat bermuatan negatif memancarkan berkas sinar yang
bergerak menurut garis lurus menuju ke pelat anoda atau pelat positif.
Sinar tersebut tidak hanya bergerak
lurus, ia juga dapat dibelokkan oleh medan magnet atau medan listrik
menuju ke kutub positif. Sinar tersebut membelok mendekati kutub positif
medan magnet atau medan listrik. Percobaan ini membuktikan bahwa sinar
yang memancar dari pleat katoda tersebut merupakan partikel yang lebih
kecil dari atom dan ia bermuatan negatif. Partikel ini kemudian disebut
dengan elektron. Berikut ilustrasi percobaan yang dilakukan oleh
thomson:

Ketika diberikan pengaruh medan magnet atau medan listrik ternyata sinar tersebut membelok ke arah kutub positif
Proton
Eugene Goldstein
Pengungkapan tentang materi dasar
penyusun atom tidak terhenti pada penemuan elektron. Pada kondisi normal
sebuah atom itu tidak bermuatan atau muatannya netral. Kemudian setelah
ditemukan adanya partikel dasar bermuatan negatif yang ada dalam atom
memunculkan dugaan kuat adanya partikel dasar lain yang bermuatan
positif yang menjadikan sebuah atom bermuatan netral. Tanda tanya besar
ini kemudian dijawab oleh seorang ilmuwan berkebangsaan Jerman bernama
Eugene Goldstein. Berangkat dari rasa penasarannya ia melakukan sebuah
eksperimen dengan menggunakan tabung hampa bermuatan listrik yang
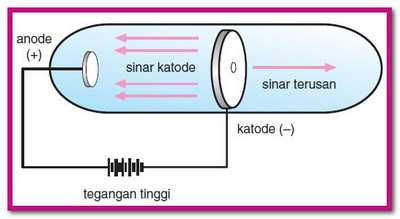
dilengkapi dengan lempeng katoda berlubang. Alhasil, dari percobaan
tersebut diketahui ada sebuah sinar yang bergerak berlawanan arah dengan
sinar katoda (disebut sinar anoda). Ia bergerak dari anoda ke katoda.
Eugen goldstein menyimpulkan bahwa sinar tersebut merupakan partikel
dasar yang mutannya positif. Berikut ilustrasi percobaan eugene
goldstein:

Ernest Rutherford
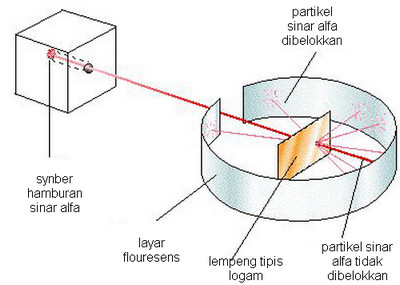
Selain Goldstein, seorang ilmuwan inggris kelahiran New Zealand bernama Ernest Rutherford
juga melakukan penelitian pada tahun 1919. Ia melakukan percobaan
dengan penghampuran sinar alfa . Sinar alfa ditembakkan pada sebuah
lepeng tipis logam yang dikelilingi layar fluorensens yang berfungsi
sebagai layar penangkap elektron.
Dari hasil percobaan penghamburan sinar
alfa tersebut diketahui bahwa hampir seluruh sinar alfa diteruskan.
Namun demikian dari sekitar 8000 partikel sinar alfa terdapat satu sinar
alfa yang dibelokkan, bahkan ada beberapa diantaranya yang dipantulkan
kembali ke arah datangnya. Ernest kemudian menarik kesimpulan bahwa ada
mutan positif berukuran besar yang ada di tengah-tengah atom. Partikel
dasar ini bermuatan positif karena ketika ada partikel sinar alfa yang
mendekatinya maka ia mengalami gaya tolak sehingga membelok atau bahkan
terpental balik.
Neutron
Partikel dasar atom berikutnya adalah
neutron. Muncul tanda tanya lagi bagi Ernest Rutherford. Setelah massa
proton dan elekton pada suatu atom dijumlah ternyata jumlahnya masih
kurang dari setengah massa atom relatifnya Massa elektron juga sangat kecil jika dibanding dengan massa proton. Massa proton sekitar 1,67 x 10-24 gram sedangkan masa elektron adalah 9,11 x 10-28 gram. Rutherford menduga masih ada partikel dasar penyusun atom selain proton dan elektron.
Tiga belas tahun kemudian tepatnya tahun
1932 James Chadwick — Ahli fisika berkebangsaan Inggris –melakukan
percobaan untuk membuktikan dugaan dari Rutherford. James melakukan
percobaan dengan menembakkan sinar alfa yang bermuatan negatif ke atom
berilium. Dari percobaan yang dilakukannya ia berhasil menemukan bahwa
selain proton dan elektron masih ada partikel dasar pernyusun atom yang
lain yang bermuatan netral yaitu neutron.
Tabel Partikel Dasar Penyusun Atom
Berikut rangkuman partikel dasar penyusun atom berikut muatan dan massanya
| Partikel | Muatan Listrik (C) | Muatan Atom | Massa (g) | Lambang | Perbandingan dengan massa proton |
| Proton | +1.6022 x 10-19 | +1 | 1.6726 x 10-24 | 1p1 | 1 |
| Neutron | 0 | 0 | 1.6740 x 10-24 | 1n0 | 1 |
| Elektron | -1.6022 x 10-19 | -1 | 9.1094 x 10-28 | -1e0 | 1/1.836 |
Identifikasi Proton, Elektron, dan Neutron
Pada tabel periodik atau pada soal sobat
akan sering diminta untuk dapat mengidentifikasi nomor massa, jumlah
proton, jumlah elektron, dan jumlah neutron. Simak contoh berikut: Dalam
sebuah atom netral karbon 126C.
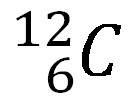
12 adalah nomor massa dan 6 adalah nomor atom
Yang perlu sobat ingat adalah dalam menentukan jumlah partikel dasar penyusun atom adalah:
- Jumlah Neutron = Nomor massa – Nomor atom
Jadi jumlah neutron = 12 – 6 = 6 - Jumlah Proton = Nomor atom
Jumlah proton = 6 - Jumlah Proton = Jumlah Elektron –> untuk atom bermuatan netral
- Jumlah Proton > Jumlah Elektron –> untuk ion bermuatan positif
- Jumlah Proton < Jumlah Elektron –> untuk ion bermuatan negatif
Latihan Soal
Untuk menambah pemahaman sobat tentang partikel dasar penyusun atom silahkan dicoba latihan soal di bawah ini:
1. Tentukan jumlah proton, elektron, dan neutron gambar atom di bawah ini:
2. Tentukan jumlah proton, elektron, dan netutron dari atom dan ion di tabel berikut (sobat bisa menggunakan bantuan tabel periodik)
- 146 C
- 35Cl-
- 24Mg2+
- 6027Co
- 40Ar
3. Tentukan nama atom atau ion dari data
partikel dasar penyusun atom/ion tersebut yang ada di bawah ini:
(gunakan tabel periodik)
- Muatan +1, 3 proton, nomor massa 6.
- 26 proton, 20 neutron.
- Muatan -2, 7 neutron, nomor massa 17.
- 28 proton, nomor massa 62.
artikel ini disalin lengkap dari: http://rumushitung.com/2015/11/23/partikel-dasar-penyusun-atom-kimia-x/
halaman utama website: http://rumushitung.com/
jika mencari artikel yang lebih menarik lagi, kunjungi halaman utama website tersebut. Terimakasih!

No comments:
Post a Comment