Minyak wangi menggunakan ester yang merupakan senyawa karbon turunan
alkana sebagai pemberi aroma wangi. Ester dapat dibuat
dengan mereaksikan asam karboksilat dan alkohol dengan katalis asam
sulfat, reaksi ini disebut esterifikasi. Bagaimanakah tata nama, isomer,
dan sifat dari ester? Bagaimana pula dengan senyawa karbon turunan
alkana lainnya, seperti haloalkana, alkohol, eter, aldehid, keton, dan
asam karboksilat? Pelajarilah bab ini agar Anda memahaminya.
A. Struktur Senyawa Karbon
Karena keunikannya, atom karbon dapat membentuk ribuan senyawa karbon.
Perhatikanlah tubuh Anda, semua bagiannya terdiri atas
senyawasenyawa karbon yang Tuhan ciptakan sedemikian rupa sehingga
menjadi suatu susunan yang utuh dan sempurna. Karbon dapat membentuk
senyawa lebih banyak dibandingkan dengan unsur yang lain karena karbon
tidak hanya membentuk ikatan tunggal, rangkap, dan rangkap tiga, tetapi
juga dapat berikatan membentuk struktur cincin. Cabang ilmu Kimia
yang berhubungan dengan senyawa karbon disebut Kimia Organik.
Legenda Kimia :
Marcellin Barthelot (1827–1907) membuat banyak senyawa organik dari senyawa-senyawa atau unsur-unsur anorganik. Dia menunjukkan bahwa tumbuh-tumbuhan dan binatang bukan sumber satu-satunya senyawa organik. (Sumber: www.fbv.fh-frankfurt.com)
Legenda Kimia :
Marcellin Barthelot
Marcellin Barthelot (1827–1907) membuat banyak senyawa organik dari senyawa-senyawa atau unsur-unsur anorganik. Dia menunjukkan bahwa tumbuh-tumbuhan dan binatang bukan sumber satu-satunya senyawa organik. (Sumber: www.fbv.fh-frankfurt.com)
Untuk memudahkan dalam mempelajari senyawa karbon, para ahli kimia mengelompokkan senyawa karbon ke dalam beberapa kelompok.
Percobaan Sederhana Kimia 1 :
Tujuan :
Menyelidiki gugus fungsi pada senyawa kimia
Alat dan Bahan :
Struktur senyawa kimia
Langkah Kerja :
1. Perhatikan struktur kimia senyawa alkana berikut.
Senyawa karbon dapat dikelompokkan berdasarkan gugus fungsi
yang dimilikinya. Gugus fungsi adalah gugus atom atau molekul yang
berperan pada sifat kimia suatu senyawa. Suatu senyawa yang memiliki
gugus fungsi yang sama akan memiliki kemiripan reaksi. Berikut ini
beberapa gugus fungsi yang lazim dimiliki senyawa karbon.
• –OH
• –Cl
4. Gantilah molekul CH di bagian ujung dengan atom/molekul berikut.
• –CO
• –COOH
• –COH
• –COOCH3
Jawablah pertanyaan berikut untuk menarik kesimpulan.
1. Apakah nama kelompok senyawa karbon yang memiliki gugus –OH?
2. Apakah nama kelompok senyawa karbon yang memiliki gugus –Cl?
3. Apakah nama kelompok senyawa karbon yang memiliki gugus –O–?
4. Apakah nama kelompok senyawa karbon yang memiliki gugus –CO?
5. Apakah nama kelompok senyawa karbon yang memiliki gugus –COH?
6. Apakah nama kelompok senyawa karbon yang memiliki gugus –COOH?
7. Apakah nama kelompok senyawa karbon yang memiliki gugus –COOCH3?
Diskusikan hasil yang Anda peroleh dengan teman Anda.
Setelah Anda menyelidiki gugus fungsi pada senyawa kimia, bandingkanlah kesimpulan yang Anda peroleh dengan penjelasan berikut.
Senyawa karbon dapat dikelompokkan berdasarkan gugus fungsi
yang dimilikinya. Gugus fungsi adalah gugus atom atau molekul yang
berperan pada sifat kimia suatu senyawa. Suatu senyawa yang memiliki
gugus fungsi yang sama akan memiliki kemiripan reaksi. Berikut ini
beberapa gugus fungsi yang lazim dimiliki senyawa karbon.
Tabel 1. Gugus Fungsi Senyawa Karbon
Gugus Fungsi
|
Kelompok Senyawa Karbon
|
– OH
|
Alkohol
|
– O –
|
eter
|
keton
| |
Aldehid
| |
– X (X = halogen)
|
haloalkana
|
asam karboksilat
| |
ester
|
Alkohol adalah senyawa karbon yang memiliki gugus hidroksil
(–OH). Haloalkana adalah senyawa karbon yang mengikat atom halogen.
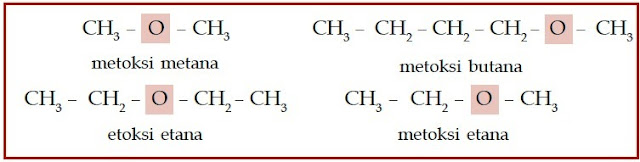
Atom halogen ini menggantikan posisi atom hidrogen. Eter adalah senyawa
karbon yang memiliki gugus alkoksi (–O–). Berikut beberapa struktur
senyawa alkohol, haloalkana, dan eter.
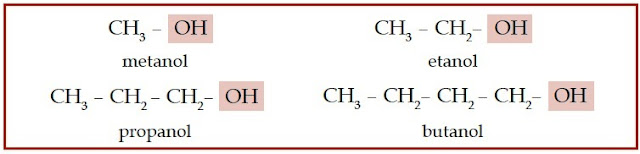 |
| Gambar 1. Struktur kimia dari sebagian senyawa alkohol. |
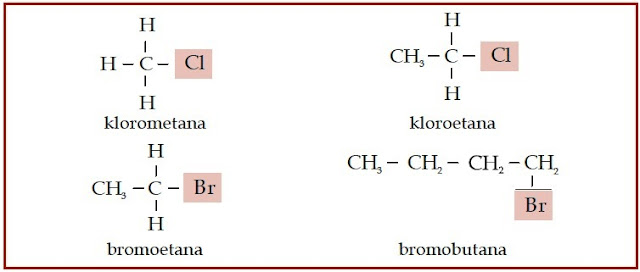 |
| Gambar 2. Pada senyawa haloalkana, atom halogen menggantikan atom hidrogen. |
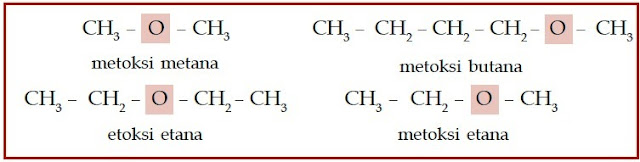 |
| Gambar 3. Struktur kimia dari sebagian senyawa eter. |
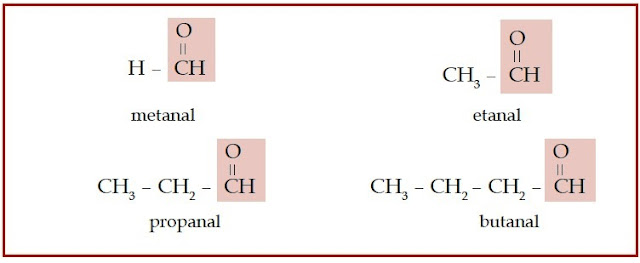
Gugus fungsi yang dimiliki keton dan aldehid dinamakan gugus karbonil,
yaitu gugus fungsi yang terdiri atas atom oksigen yang berikatan rangkap
dengan atom karbon. Jika gugus karbonil tersebut diapit oleh dua atau
lebih atom karbon, senyawa karbon tersebut dinamakan keton. Jika gugus
karbonil terletak di ujung rantai karbon, senyawa karbon seperti
ini disebut aldehid.
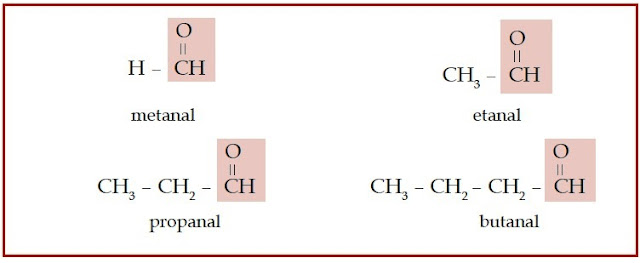 |
| Gambar 4. Senyawa aldehid memiliki gugus karbonil yang terletak di ujung rantai karbon. |
 |
| Gambar 5. Senyawa keton memiliki gugus karbonil yang diapit atom-atom karbon. |
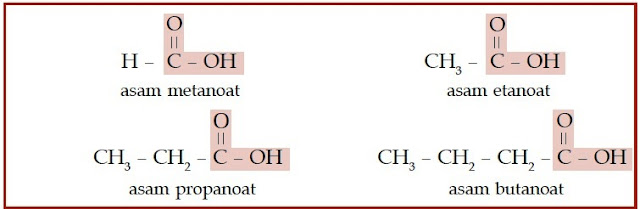
Bagaimanakah dengan asam karboksilat dan ester? Asam karboksilat dan
ester juga memiliki gugus karbonil. Perbedaannya dengan keton
dan aldehid adalah atom oksigen yang diikatnya berjumlah dua. Satu
atom oksigen berikatan ganda dengan atom karbon, sedangkan satunya
berikatan tunggal dengan atom karbon. Atom oksigen yang berikatan
tunggal dengan atom karbon, berikatan juga dengan atom hidrogen (untuk
asam karboksilat), dan berikatan dengan gugus alkil (untuk ester).
Perhatikan struktur asam karboksilat dan ester berikut.
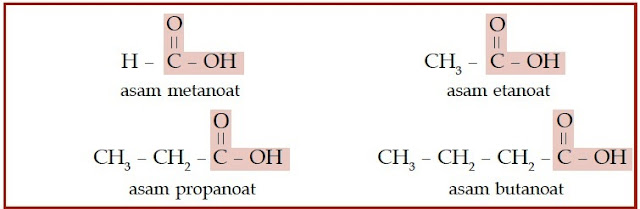 |
| Gambar 6. Senyawa asam karboksilat memiliki gugus COOH yang terletak di ujung rantai karbon. |
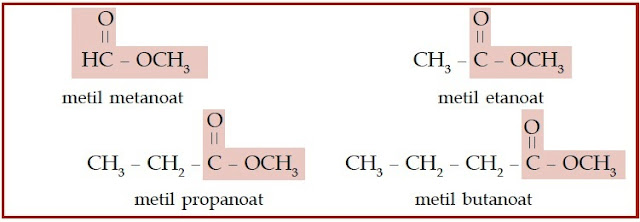 |
| Gambar 7. Pada senyawa ester, gugus alkil menggantikan atom hidrogen pada asam karboksilat. |
B. Tata Nama Senyawa Karbon
Sebelumnya, Anda telah mengetahui pengelompokan senyawa
karbon berdasarkan gugus fungsi yang dimilikinya. Anda juga telah
mengetahui beberapa struktur kimia dari senyawa-senyawa tersebut pada
Gambar 1, 2, 3, 4, 5, 6, dan 7. Tahukah Anda, cara memberi nama
senyawasenyawa karbon tersebut? Penulisan nama senyawa karbon tidak
jauh berbeda dengan penulisan nama senyawa hidrokarbon golongan alkana.
Contoh Soal 1 :
Tentukanlah nama senyawa hidrokarbon berikut.
Kunci Jawaban :
a. Struktur kimia CH4 dapat digambarkan sebagai berikut.
CH4 memiliki ikatan tunggal (-ana) dengan jumlah atom C sebanyak 1 (meta). Jadi, CH4 memiliki nama metana.
b. Struktur kimia C2H6 dapat digambarkan sebagai berikut.
C2H6 memiliki ikatan tunggal (-ana) dengan jumlah atom C sebanyak 2 (eta). Jadi, C2H6 memiliki nama etana.
c. Struktur kimia C3H8 dapat digambarkan sebagai berikut.
C3H8 memiliki ikatan tunggal (-ana) dengan jumlah atom C sebanyak 3 (propa-). Jadi, C3H8 memiliki nama propana.
d. Struktur kimia C4H10 dapat digambarkan sebagai berikut.
C4H10 memiliki ikatan tunggal (-ana) dengan jumlah atom C sebanyak 4 (buta-). Jadi, C4H10 memiliki nama butana.
Contoh Soal 1 :
Tentukanlah nama senyawa hidrokarbon berikut.
a. CH4
b. C2H6
c. C3H8
d.
C4H10Kunci Jawaban :
a. Struktur kimia CH4 dapat digambarkan sebagai berikut.
CH4 memiliki ikatan tunggal (-ana) dengan jumlah atom C sebanyak 1 (meta). Jadi, CH4 memiliki nama metana.
b. Struktur kimia C2H6 dapat digambarkan sebagai berikut.
C2H6 memiliki ikatan tunggal (-ana) dengan jumlah atom C sebanyak 2 (eta). Jadi, C2H6 memiliki nama etana.
c. Struktur kimia C3H8 dapat digambarkan sebagai berikut.
C3H8 memiliki ikatan tunggal (-ana) dengan jumlah atom C sebanyak 3 (propa-). Jadi, C3H8 memiliki nama propana.
d. Struktur kimia C4H10 dapat digambarkan sebagai berikut.
C4H10 memiliki ikatan tunggal (-ana) dengan jumlah atom C sebanyak 4 (buta-). Jadi, C4H10 memiliki nama butana.
1. Tata Nama Alkohol dan Eter
Pada prinsipnya, penamaan senyawa turunan alkana sama dengan penamaan
senyawa alkana. Caranya adalah dengan mengubah akhiran -ana dengan
akhiran lain sesuai dengan gugus fungsi yang dimiliki setiap kelompok
senyawa.
Catatan Kimia :
Senyawa alkohol memiliki gugus fungsi OH dengan rumus umum CnH2n+2O.
Catatan Kimia :
Senyawa alkohol memiliki gugus fungsi OH dengan rumus umum CnH2n+2O.
Percobaan Kimia Sederhana 2 :
Tata Nama Alkohol
Tujuan :
Menyelidiki aturan tata nama alkohol
Alat dan Bahan :
Data struktur dan rumus kimia senyawa
Langkah Kerja :
1. Amatilah tabel berikut.
Tata Nama Alkohol
Tujuan :
Menyelidiki aturan tata nama alkohol
Alat dan Bahan :
Data struktur dan rumus kimia senyawa
Langkah Kerja :
1. Amatilah tabel berikut.
Struktur
|
Rumus
Kimia
|
Nama
|
|
Alkana
|
CH4
|
Metana
|
|
C2H6
|
Etana
|
||
Alkohol
|
CH3OH
|
Metanol
|
|
C2H5OH
|
Etanol
|
Bandingkanlah kesimpulan yang Anda peroleh dengan penjelasan berikut.
Jika diperhatikan dengan saksama, perbedaan yang paling jelas antara alkana dan alkohol adalah jenis gugus fungsinya. Senyawa alkohol memiliki gugus fungsi –OH dengan rumus umum CnH2n+2O Berdasarkan rumus tersebut, kita dapat mengetahui rumus kimia suatu alkohol dengan cara menghitung jumlah atom C-nya. Tabel berikut memperlihatkan rumus kimia beberapa senyawa alkohol.
Jika diperhatikan dengan saksama, perbedaan yang paling jelas antara alkana dan alkohol adalah jenis gugus fungsinya. Senyawa alkohol memiliki gugus fungsi –OH dengan rumus umum CnH2n+2O Berdasarkan rumus tersebut, kita dapat mengetahui rumus kimia suatu alkohol dengan cara menghitung jumlah atom C-nya. Tabel berikut memperlihatkan rumus kimia beberapa senyawa alkohol.
Tabel 2. Rumus Kimia Beberapa Senyawa Alkohol
Jumlah Atom C
|
Rumus Kimia
Alkohol
|
1
|
CH3OH
|
2
|
C2H5OH
|
3
|
C3H7OH
|
4
|
C4H9OH
|
5
|
C5H11OH
|
6
|
C6H13OH
|
7
|
C7H15OH
|
8
|
C8H17OH
|
9
|
C9H19OH
|
Gugus hidroksil pada senyawa alkohol menggantikan posisi 1 atom H pada
senyawa alkana. Oleh karena gugus fungsi –OH menggantikan posisi 1 atom H
maka penamaan alkohol dilakukan dengan cara mengganti akhiran -ana
menjadi -nol. Jadi, CH3OH memiliki nama metanol, sedangkan C2H5OH memiliki
nama etanol. Aturan tersebut hanya berlaku jika jumlah atom karbon pada
senyawa alkohol tidak lebih dari 2. Bagaimanakah jika jumlah atom
karbon pada senyawa alkohol lebih dari 2? Senyawa alkohol yang
mengandung lebih dari 2 atom karbon akan memiliki struktur kimia lebih
dari satu. Misalnya, senyawa alkohol dengan rumus kimia C3H7OH memiliki dua struktur kimia. Perhatikanlah gambar berikut.
Dari gambar tersebut, dapat disimpulkan bahwa kedua struktur
senyawa alkohol tersebut hanya berbeda pada posisi gugus –OH. Apa nama
kedua senyawa alkohol tersebut? Berikut langkah-langkah penamaan senyawa
alkohol.
Catatan Kimia :
Penamaan alkohol yang sederhana yaitu dengan mengubah suku kata terakhir dari suatu alkana menjadi nol. Misalnya, etana menjadi etanol.
Catatan Kimia :
Penamaan alkohol yang sederhana yaitu dengan mengubah suku kata terakhir dari suatu alkana menjadi nol. Misalnya, etana menjadi etanol.
Aturan Penamaan Senyawa Alkohol Rantai Lurus
- Periksalah jenis gugus fungsinya. Jika memiliki gugus –OH, berarti senyawa tersebut merupakan senyawa alkohol.
- Hitung jumlah atom C-nya.
- Jika jumlahnya tidak lebih dari dua, tuliskan awalan berdasarkan jumlah atom C-nya dan diakhiri dengan akhiran -nol.
- Jika jumlahnya lebih dari dua, beri nomor pada rantai karbon sedemikian rupa sehingga gugus –OH menempel pada atom C yang paling kecil. Kemudian, tuliskan nomor, diikuti nama awalan berdasarkan jumlah atom C-nya, dan diakhiri dengan akhiran -nol.
Agar Anda lebih memahami cara penamaan senyawa alkohol, pelajarilah contoh soal berikut
Contoh Soal 2 :
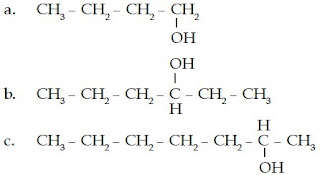
Tentukanlah nama senyawa alkohol berikut.
Kunci Jawaban :
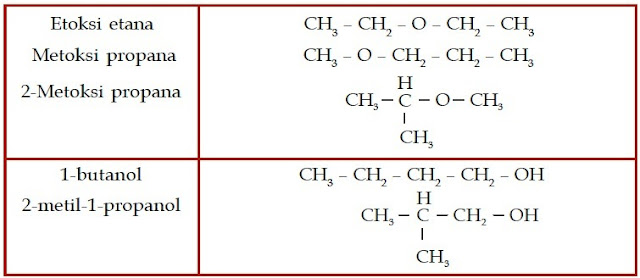
a. Dari struktur kimianya, dapat diketahui bahwa senyawa alkohol ini memiliki 4 atom C dan gugus –OH-nya berada pada atom C nomor 1 sehingga namanya adalah 1-butanol.
b. Dari struktur kimianya, dapat diketahui bahwa senyawa alkohol ini memiliki 6 atom C dan gugus –OH-nya berada pada atom C nomor 3 sehingga namanya adalah 3-heksanol.
c. Dari struktur kimianya, dapat diketahui bahwa senyawa alkohol ini memiliki 7 atom C dan gugus –OH-nya berada pada atom C nomor 2 sehingga namanya adalah 2-heptanol.
Contoh Soal 3 :
Gambarkanlah struktur senyawa alkohol berikut.
a. 2-butanol
b. 2-heksanol
Kunci Jawaban :
Untuk menuliskan struktur senyawa alkohol, tentukan terlebih dahulu rantai karbonnya. Kemudian, tempatkan gugus – OH.
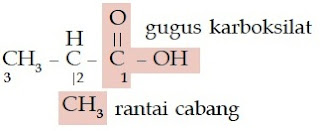
Seperti halnya senyawa alkana, struktur senyawa alkohol juga ada yang memiliki rantai cabang. Bagaimanakah penamaan senyawa alkohol bercabang? Berikut aturan penamaan senyawa alkohol yang memiliki rantai cabang.
Contoh Soal 2 :
Tentukanlah nama senyawa alkohol berikut.
Kunci Jawaban :
a. Dari struktur kimianya, dapat diketahui bahwa senyawa alkohol ini memiliki 4 atom C dan gugus –OH-nya berada pada atom C nomor 1 sehingga namanya adalah 1-butanol.
b. Dari struktur kimianya, dapat diketahui bahwa senyawa alkohol ini memiliki 6 atom C dan gugus –OH-nya berada pada atom C nomor 3 sehingga namanya adalah 3-heksanol.
c. Dari struktur kimianya, dapat diketahui bahwa senyawa alkohol ini memiliki 7 atom C dan gugus –OH-nya berada pada atom C nomor 2 sehingga namanya adalah 2-heptanol.
Contoh Soal 3 :
Gambarkanlah struktur senyawa alkohol berikut.
a. 2-butanol
b. 2-heksanol
Kunci Jawaban :
Untuk menuliskan struktur senyawa alkohol, tentukan terlebih dahulu rantai karbonnya. Kemudian, tempatkan gugus – OH.
Seperti halnya senyawa alkana, struktur senyawa alkohol juga ada yang memiliki rantai cabang. Bagaimanakah penamaan senyawa alkohol bercabang? Berikut aturan penamaan senyawa alkohol yang memiliki rantai cabang.
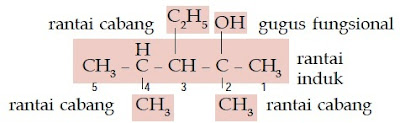
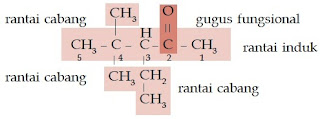
Aturan Penamaan Senyawa Alkohol Rantai Bercabang
- Tentukanlah rantai induk (rantai terpanjang yang memiliki gugus –OH) dan rantai cabangnya.
- Beri nomor pada rantai induk sedemikian rupa sehingga gugus –OH menempel pada atom C yang paling kecil.
- Rantai induk diberi nama sesuai aturan penamaan senyawa alkohol rantai lurus.
- Rantai cabang diberi nama sesuai jumlah atom C dan struktur gugus alkil.
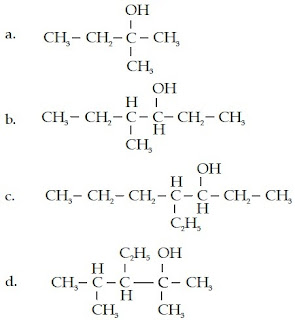
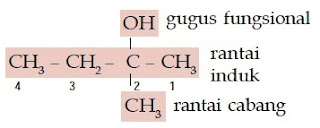
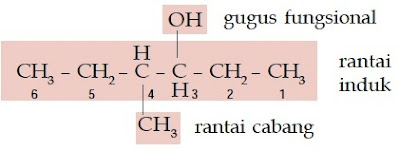
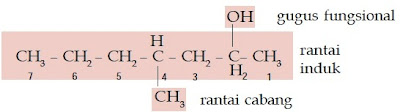
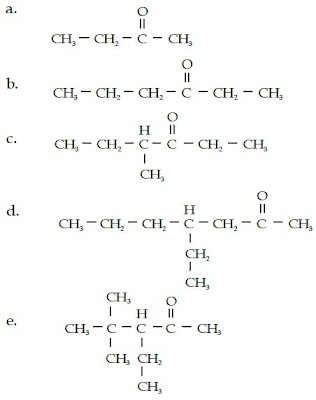
Contoh Soal 4 :
Tentukanlah nama senyawa alkohol berikut.
Kunci Jawaban :
a.
Senyawa alkohol ini memiliki rantai lurus yang terdiri atas 4 atom C, gugus –OH, dan gugus metilnya berada pada atom C nomor 2 sehingga namanya adalah 2- metil-2-butanol.
b.
Senyawa alkohol ini memiliki rantai lurus yang terdiri atas 6 atom C, gugus –OH berada pada atom C nomor 3, sedangkan gugus metilnya berada pada atom C nomor 4 sehingga namanya adalah 4-metil-3-heksanol.
c.
Senyawa alkohol ini memiliki rantai lurus yang terdiri atas 7 atom C, gugus –OH berada pada atom C nomor 2, sedangkan gugus metilnya berada pada atom C nomor 4 sehingga namanya adalah 4-metil-2-heptanol.
d.
Senyawa alkohol ini memiliki rantai lurus yang terdiri atas 5 atom C dan gugus –OH berada pada atom C nomor 2. Rantai cabangnya berjumlah 3 buah, yaitu 2 gugus metil yang berada pada atom C nomor 2 dan 4 serta gugus etil yang berada pada atom C nomor 3 sehingga namanya adalah 3-etil-2,4-dimetil-2-pentanol.
Tata nama alkohol yang telah diuraikan merupakan nama IUPAC. Selain nama IUPAC, alkohol juga memiliki nama trivial (nama lazim). Berikut cara memberi nama trivial untuk alkohol.
Tentukanlah nama senyawa alkohol berikut.
Kunci Jawaban :
a.
Senyawa alkohol ini memiliki rantai lurus yang terdiri atas 4 atom C, gugus –OH, dan gugus metilnya berada pada atom C nomor 2 sehingga namanya adalah 2- metil-2-butanol.
b.
Senyawa alkohol ini memiliki rantai lurus yang terdiri atas 6 atom C, gugus –OH berada pada atom C nomor 3, sedangkan gugus metilnya berada pada atom C nomor 4 sehingga namanya adalah 4-metil-3-heksanol.
c.
Senyawa alkohol ini memiliki rantai lurus yang terdiri atas 7 atom C, gugus –OH berada pada atom C nomor 2, sedangkan gugus metilnya berada pada atom C nomor 4 sehingga namanya adalah 4-metil-2-heptanol.
d.
Senyawa alkohol ini memiliki rantai lurus yang terdiri atas 5 atom C dan gugus –OH berada pada atom C nomor 2. Rantai cabangnya berjumlah 3 buah, yaitu 2 gugus metil yang berada pada atom C nomor 2 dan 4 serta gugus etil yang berada pada atom C nomor 3 sehingga namanya adalah 3-etil-2,4-dimetil-2-pentanol.
Tata nama alkohol yang telah diuraikan merupakan nama IUPAC. Selain nama IUPAC, alkohol juga memiliki nama trivial (nama lazim). Berikut cara memberi nama trivial untuk alkohol.
Aturan Penamaan Trivial Senyawa Alkohol
- Tentukanlah rantai induk (rantai terpanjang yang memiliki gugus –OH) dan rantai cabangnya.
- Beri nomor pada rantai induk sedemikian rupa sehingga gugus –OH menempel pada atom C yang paling kecil.
- Tuliskan nama alkil rantai induk diikuti kata alkohol.
Contoh Soal 5 :
Tentukanlah nama trivial senyawa alkohol berikut.
a. CH3 – OH
b. CH3 – CH2
– OH
c. CH3 – CH2
– CH2 – OH
a. alkil CH3 – OH gugus fungsional
Senyawa alkohol ini memiliki rantai alkil yang terdiri atas 1 atom C (metil) sehingga nama trivialnya adalah metil alkohol.
b. alkil CH3CH2 – OH gugus fungsional
Senyawa alkohol ini memiliki rantai alkil yang terdiri atas 2 atom C (etil) sehingga nama trivialnya adalah etil alkohol.
c. CH3CH2CH2 – OH gugus fungsional
Senyawa alkohol ini memiliki rantai alkil lurus yang terdiri atas 3 atom
C (propil) sehingga nama trivialnya adalah propil alkohol.
d.
Senyawa alkohol ini memiliki rantai alkil bercabang dengan nama isopropil sehingga nama trivialnya adalah isopropil alkohol.
e.
Senyawa alkohol ini memiliki rantai alkil bercabang dengan nama isobutil sehingga nama trivialnya adalah isobutil alkohol.
f.
Senyawa alkohol ini memiliki rantai alkil bercabang dengan nama sek-butil sehingga nama trivialnya adalah sek-butil alkohol.
Senyawa alkohol dapat juga dikelompokkan menjadi alkohol primer,
alkohol sekunder, dan alkohol tersier. Apakah perbedaan ketiga jenis
alkohol tersebut? Alkohol primer, alkohol sekunder, dan alkohol tersier
dibedakan berdasarkan jumlah atom C yang terikat pada atom C yang
mengikat gugus –OH. Alkohol primer mengikat 1 atom C, alkohol sekunder
mengikat 2 atom C, sedangkan alkohol tersier mengikat 3 atom C.
Percobaan Kimia Sederhana 3 :
Tata Nama Eter
Tujuan :
Menyelidiki struktur dan aturan tata nama eter
Alat dan Bahan :
Data struktur dan rumus kimia senyawa
Langkah Kerja :
Amatilah tabel berikut.
Alkohol primer
|
CH3CH2CH2OH
|
Alkohol sekunder
|
|
Alkohol tersier
|
Percobaan Kimia Sederhana 3 :
Tata Nama Eter
Tujuan :
Menyelidiki struktur dan aturan tata nama eter
Alat dan Bahan :
Data struktur dan rumus kimia senyawa
Langkah Kerja :
Amatilah tabel berikut.
Struktur
|
Rumus
Kimia
|
Nama
|
|
Alkana
|
CH3 – CH3
|
C2H6
|
Etana
|
CH3 – CH2 – CH3
|
C3H8
|
Propana
|
|
Eter
|
CH3 – O – C CH3
|
C2H6O
|
Metoksi
metana
|
CH3 – O – CH2 – CH3
|
C3H8O
|
Metoksi
etana
|
Jawablah pertanyaan berikut untuk menarik kesimpulan.
1. Adakah hubungan antara nama senyawa, jenis gugus fungsi, dan jumlah atom C?
2. Bagaimanakah cara memberi nama senyawa eter?
3. Apakah rumus umum dari eter?
Diskusikan hasil yang Anda peroleh dengan teman Anda.
1. Adakah hubungan antara nama senyawa, jenis gugus fungsi, dan jumlah atom C?
2. Bagaimanakah cara memberi nama senyawa eter?
3. Apakah rumus umum dari eter?
Diskusikan hasil yang Anda peroleh dengan teman Anda.
Bandingkanlah kesimpulan yang Anda peroleh dengan penjelasan berikut.
Jika diperhatikan dengan saksama, perbedaan yang paling mencolok antara
alkana dan eter adalah jenis gugus fungsinya. Senyawa eter
memiliki gugus fungsi –OR (gugus alkoksi). Gugus fungsi alkoksi
menggantikan satu atom karbon pada alkana. Rumus umum dari eter adalah
CnH2n+2O.
Berdasarkan rumus tersebut, kita dapat mengetahui rumus kimia suatu eter dengan cara menghitung jumlah atom C-nya.
Tabel berikut memperlihatkan rumus kimia beberapa senyawa eter.
Tabel 3. Rumus Kimia Beberapa Senyawa Eter
Jumlah Atom C
|
Rumus Kimia Eter
|
2
|
C2H6OH
|
3
|
C3H8OH
|
4
|
C4H10OH
|
5
|
C5H12OH
|
6
|
C6H14OH
|
7
|
C7H16OH
|
8
|
C8H18OH
|
9
|
C9H20OH
|
Dari rumus umum eter, dapatkah Anda menentukan struktur kimia dan tata
namanya? Struktur kimia eter adalah R – O – R. R adalah gugus
alkil. Adapun tata cara memberi nama eter secara IUPAC adalah sebagai
berikut.
Contoh Soal 6 :
Tentukanlah nama senyawa eter berikut.
a. CH3 – CH2 – O – CH2 – CH3
b. CH3 – CH2 – O – CH2 – CH2 – CH3
Kunci Jawaban :
a. rantai induk CH3 – CH2 – O – CH2 – CH3 alkoksi
Gugus alkoksi: – O – CH2 – CH3 (etoksi)
Rantai induk: CH3 – CH2 (etana)
Jadi, nama senyawa tersebut adalah 1-etoksi etana.
b. alkoksi CH3 – CH2 – O – CH2 – CH2 – CH3 rantai induk
Gugus alkoksi: – O – CH2 – CH2 – CH3 (etoksi)
Rantai induk: CH3 – CH2 – CH2 (propana)
Jadi, nama senyawa tersebut adalah 1-etoksi propana.
c.
Gugus alkoksi: – O – CH2 – CH3 (etoksi)
Rantai induk:
Jadi, nama senyawa tersebut adalah 2-etoksi propana.
d.
Gugus alkoksi: – O – CH3 (metoksi)
Rantai induk:
Contoh Soal 7 :
Tentukanlah nama trivial senyawa eter berikut.
a. CH3 – CH2 – O – CH2 – CH3
b. CH3 – CH2 – O – CH2 – CH2 – CH3
Tentukanlah nama senyawa eter berikut.
a. CH3 – CH2 – O – CH2 – CH3
b. CH3 – CH2 – O – CH2 – CH2 – CH3
Kunci Jawaban :
a. rantai induk CH3 – CH2 – O – CH2 – CH3 alkoksi
Gugus alkoksi: – O – CH2 – CH3 (etoksi)
Rantai induk: CH3 – CH2 (etana)
Jadi, nama senyawa tersebut adalah 1-etoksi etana.
b. alkoksi CH3 – CH2 – O – CH2 – CH2 – CH3 rantai induk
Gugus alkoksi: – O – CH2 – CH2 – CH3 (etoksi)
Rantai induk: CH3 – CH2 – CH2 (propana)
Jadi, nama senyawa tersebut adalah 1-etoksi propana.
c.
Gugus alkoksi: – O – CH2 – CH3 (etoksi)
Rantai induk:
Jadi, nama senyawa tersebut adalah 2-etoksi propana.
d.
Gugus alkoksi: – O – CH3 (metoksi)
Rantai induk:
Aturan Penamaan Senyawa Eter
- Periksalah jenis gugus fungsinya. Jika memiliki gugus –OR, berarti senyawa tersebut merupakan senyawa eter.
- Rantai alkil yang jumlah atom C-nya paling sedikit disebut gugus alkoksi, sedangkan yang jumlahnya paling banyak disebut rantai induk.
- Gugus alkoksi diberi nama dengan cara mengganti akhiran -ana pada alkana menjadi akhiran -oksi, sedangkan rantai induk diberi nama seperti nama alkana berdasarkan jumlah atom C-nya.
- Jika jumlah atom C lebih dari 4, beri nomor pada rantai induk sedemikian rupa sehingga gugus –OR menempel pada atom C yangpaling kecil. Kemudian, tuliskan nomor, diikuti nama gugus alkoksi berdasarkan jumlah atom C-nya, dan diakhiri dengan nama rantai induk.
Contoh Soal 7 :
Tentukanlah nama trivial senyawa eter berikut.
a. CH3 – CH2 – O – CH2 – CH3
b. CH3 – CH2 – O – CH2 – CH2 – CH3
Kunci Jawaban :
a. Senyawa eter ini memiliki dua rantai alkil yang jumlah atom C-nya sama, yakni 2 (etil). Jadi, nama trivialnya adalah dietil eter.
b. Senyawa eter ini memiliki dua rantai alkil yang jumlah atom C-nya berbeda, yakni 2 (etil) dan 3 (propil). Jadi, nama trivialnya adalah etil propil eter.
c. Senyawa eter ini memiliki dua rantai alkil yang jumlah atom C-nya berbeda, yakni 2 (etil) dan 3 (isopropil). Jadi, nama trivialnya adalah etil isopropil eter.
a. Senyawa eter ini memiliki dua rantai alkil yang jumlah atom C-nya sama, yakni 2 (etil). Jadi, nama trivialnya adalah dietil eter.
b. Senyawa eter ini memiliki dua rantai alkil yang jumlah atom C-nya berbeda, yakni 2 (etil) dan 3 (propil). Jadi, nama trivialnya adalah etil propil eter.
c. Senyawa eter ini memiliki dua rantai alkil yang jumlah atom C-nya berbeda, yakni 2 (etil) dan 3 (isopropil). Jadi, nama trivialnya adalah etil isopropil eter.
2. Tata Nama Aldehid Keton Asam Karboksilat dan Ester
 sehingga gugus ini disebut dengan nama karboksil.
sehingga gugus ini disebut dengan nama karboksil.Percobaan Kimia Sederhana 4 :
Tujuan :
Menyelidiki aturan tata nama aldehid, keton, asam karboksilat, dan eter
Alat dan Bahan :
Data struktur dan rumus kimia senyawa
Langkah Kerja :
1. Amatilah tabel berikut.
Senyawa
|
Struktur
|
Nama
|
Alkana
|
Metana
|
|
Etana
|
||
Propana
|
||
Aldehid
|
Metanal
|
|
Etanal
|
||
Propanal
|
||
Asam Karboksilat
|
Asam
metanoat
|
|
Asam
etanoat
|
||
Asam
propanoat
|
||
Keton
|
Propanon
|
|
Ester
|
Metil
metanoat
|
Jawablah pertanyaan berikut untuk menarik kesimpulan.
- Adakah hubungan antara nama senyawa alkana dengan nama senyawa aldehid, keton, asam karboksilat, dan ester?
- Bagaimanakah cara memberi nama senyawa aldehid?
- Bagaimanakah cara memberi nama senyawa keton?
- Apakah rumus umum dari aldehid dan keton?
Seperti halnya alkohol dan eter, nama senyawa aldehid, keton, dan
asam karboksilat berhubungan dengan nama senyawa alkana. Pada aldehid,
akhiran -a pada alkana diganti menjadi akhiran -al. Itulah sebabnya
senyawa aldehid disebut juga alkanal. Pada keton, akhiran -a pada alkana
diganti menjadi akhiran -on. Itulah sebabnya senyawa keton disebut juga
alkanon. Pada asam karboksilat, akhiran -a pada alkana diganti menjadi
akhiran -oat dan diawali dengan kata asam. Itulah sebabnya senyawa asam
karboksilat disebut juga asam alkanoat. Agar lebih jelas, berikut aturan
penamaan senyawa aldehid.
Aturan Penamaan Senyawa Aldehid
- Periksalah jenis gugus fungsinya. Jika memiliki gugus –COH, berarti senyawa tersebut merupakan senyawa aldehid.
- Hitung jumlah atom C-nya, lalu tuliskan awalan berdasarkan jumlah atom C-nya dan diakhiri dengan akhiran -al.
- Jika memiliki rantai bercabang, beri nomor pada rantai terpanjang dimulai dari atom C yang mengikat atom O. Lalu, tuliskan nomor percabangan, nama alkil rantai cabang, nama rantai induk berdasarkan jumlah atom C-nya dan diakhiri dengan akhiran -al.
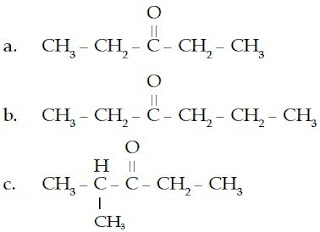
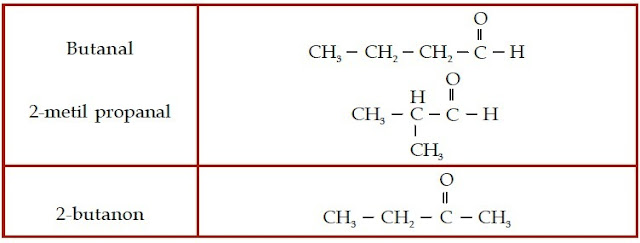
Contoh Soal 8 :
Tentukan nama IUPAC senyawa aldehid berikut.
Jumlah atom C pada rantai lurus adalah 3 (propana).
Jumlah atom C pada rantai lurus adalah 3 (propana)
Jumlah percabangan: 1
Jumlah atom C pada rantai cabang: 1 (metil)
Nomor percabangan: 2
c.
Jumlah atom C pada rantai lurus adalah 5 (pentana)
Jumlah percabangan: 1
Jumlah atom C pada rantai cabang: 1 (metil)
Nomor percabangan: 3
Jadi, nama senyawa tersebut adalah 3-metil-pentanal.
Catatan Kimia :
Tentukan nama IUPAC senyawa aldehid berikut.
Kunci Jawaban :
a.Jumlah atom C pada rantai lurus adalah 3 (propana).
Jadi, nama senyawa tersebut adalah propanal.
b.
Jumlah percabangan: 1
Jumlah atom C pada rantai cabang: 1 (metil)
Nomor percabangan: 2
c.
Jumlah atom C pada rantai lurus adalah 5 (pentana)
Jumlah percabangan: 1
Jumlah atom C pada rantai cabang: 1 (metil)
Nomor percabangan: 3
Jadi, nama senyawa tersebut adalah 3-metil-pentanal.
Catatan Kimia :
Formalin
Formalin adalah nama umum untuk larutan 33% formaldehid, yaitu
senyawa aldehid yang dikenal juga dengan nama metanal. Senyawa ini umum
digunakan untuk mengawetkan tubuh organisme yang sudah mati.
Bagaimanakah pendapat Anda mengenai penggunaan formalin pada
bahan makanan?
Masih ingatkah Anda dengan struktur aldehid dan asam
karboksilat? Dapatkah Anda melihat persamaan dan perbandingan kedua
struktur senyawa karbon tersebut? Bandingkanlah struktur aldehid dan
asam karboksilat berikut.
Dari struktur tersebut, Anda pasti melihat bahwa perbedaan kedua senyawa
tersebut terletak pada gugus fungsionalnya. Aldehid bergugus fungsional
–CHO, sedangkan asam karboksilat bergugus fungsi –COOH. Oleh karena
memiliki struktur yang mirip maka penamaan asam karboksilat mirip juga
dengan penamaan aldehid. Jika pada aldehid, akhiran -a pada alkana
diganti menjadi akhiran -al, pada asam karboksilat menjadi akhiran -oat
dan diawali dengan kata asam.
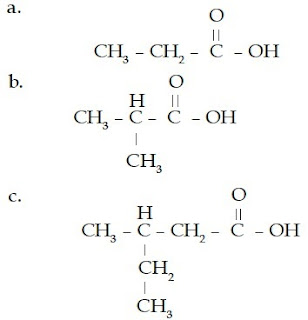
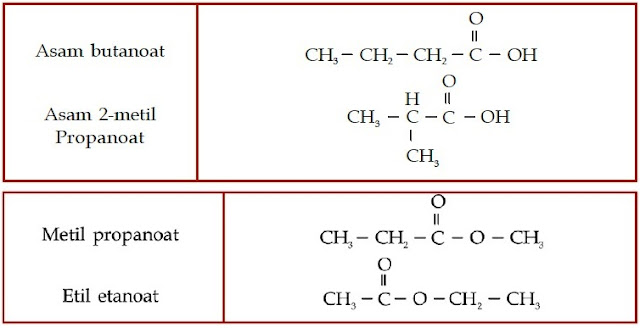
Aturan Penamaan Senyawa Asam Karboksilat
- Periksalah jenis gugus fungsinya. Jika memiliki gugus –COOH, berarti senyawa tersebut merupakan senyawa asam karboksilat.
- Jika tidak memiliki rantai cabang, hitung jumlah atom C-nya, lalu tuliskan kata asam, diikuti nama rantai induk berdasarkan jumlah atom C-nya, dan diakhiri dengan akhiran -oat.
- Jika memiliki rantai bercabang, beri nomor pada rantai terpanjang dimulai dari atom C yang mengikat atom O. Lalu, tuliskan nomor percabangan, nama alkil rantai cabang, nama rantai induk berdasarkan jumlah atom C-nya dan diakhiri dengan akhiran -oat.
Contoh Soal 8 :
Tentukanlah nama IUPAC senyawa aldehid berikut.
Kunci Jawaban :
a.
Jumlah atom C pada rantai lurus adalah 3 (propana). Jadi, nama senyawa tersebut adalah asam propanoat.
b.
Jumlah atom C pada rantai lurus adalah 3 (propana)
Jumlah percabangan: 1
Jumlah atom C pada rantai cabang: 1 (metil)
Nomor percabangan: 2
Jadi, nama senyawa tersebut adalah asam 2-metil-propanoat.
c.
Jumlah atom C pada rantai lurus adalah 5 (pentana)
Jumlah percabangan: 1
Jumlah atom C pada rantai cabang: 1 (metil)
Nomor percabangan: 3
Jadi, nama senyawa tersebut adalah asam 3-metil-pentanoat.
Seperti senyawa karbon lainnya, asam karboksilat dan aldehid memiliki nama trivial. Nama trivial kedua senyawa ini diambil dari sumber alami asam karboksilat. Perhatikan tabel berikut.
Tentukanlah nama IUPAC senyawa aldehid berikut.
Kunci Jawaban :
a.
Jumlah atom C pada rantai lurus adalah 3 (propana). Jadi, nama senyawa tersebut adalah asam propanoat.
b.
Jumlah atom C pada rantai lurus adalah 3 (propana)
Jumlah percabangan: 1
Jumlah atom C pada rantai cabang: 1 (metil)
Nomor percabangan: 2
Jadi, nama senyawa tersebut adalah asam 2-metil-propanoat.
c.
Jumlah atom C pada rantai lurus adalah 5 (pentana)
Jumlah percabangan: 1
Jumlah atom C pada rantai cabang: 1 (metil)
Nomor percabangan: 3
Jadi, nama senyawa tersebut adalah asam 3-metil-pentanoat.
Seperti senyawa karbon lainnya, asam karboksilat dan aldehid memiliki nama trivial. Nama trivial kedua senyawa ini diambil dari sumber alami asam karboksilat. Perhatikan tabel berikut.
Tabel 4. Nama IUPAC dan Trivial Beberapa Senyawa Asam Karboksilat
Rumus
Kimia
|
Nama
UPAC
|
Nama
Trivial
|
Asal
Kata
|
HCOOH
|
Asam
metanoat
|
Asam
format
|
Latin: formica
(semut)
|
CH3COOH
|
Asam
etanoat
|
Asam
asetat
|
Latin: asetum
(cuka)
|
CH3CH2COOH
|
Asam
propanoat
|
Asam propionat
|
Yunani: protopion
(lemak pertama)
|
CH3(CH2)2COOH
|
Asam
butanoat
|
Asam
butirat
|
Latin: butyrum
(mentega)
|
CH3(CH2)3COOH
|
Asam
pentanoat
|
Asam
valerat
|
Latin: valere
(tanaman valere)
|
CH3(CH2)10COOH
|
Asam
dodekanoat
|
Asam
laurat
|
Latin: laurel
(sejenis kacang)
|
CH3(CH2)14COOH
|
Asam heksadekanoat
|
Asam
palmitat
|
Minyak
palma
|
CH3(CH2)16COOH
|
Asam oktadekanoat
|
Asam
stearat
|
Yunani: stear
(lemak)
|
Tabel tersebut menjelaskan nama trivial asam karboksilat, bagaimana
dengan nama trivial aldehid? Hilangkanlah kata asam, lalu ganti akhiran
-at pada nama asam karboksilat dengan akhiran -aldehid. Perhatikan tabel
berikut.
Tabel 5 Nama IUPAC dan Trivial Beberapa Senyawa Aldehid
Jumlah
Atom C
|
Nama
UPAC
|
Nama
Trivial
|
1
|
Asam Karboksilat
|
Aldehid
|
2
|
Asam
format
|
Formaldehid
|
3
|
Asam
asetat
|
Asetaldehid
|
4
|
Asam
propionat
|
Propionaldehid
|
5
|
Asam
propionat
|
Butiraldehid
|
6
|
Asam
valerat
|
Valeraldehid
|
Pernahkah Anda mencium aroma dari minyak wangi? Mengapa minyak wangi
dapat memberikan aroma, seperti jeruk, pisang, atau apel? Aroma tersebut
berasal dari senyawa kimia yang terkandung dalam minyak wangi. Senyawa
kimia itu adalah ester. Tahukah Anda, bagaimana cara memberi nama ester?
Tata nama ester didasarkan pada strukturnya yang mirip dengan struktur
asam karboksilat. Perhatikan struktur senyawa berikut.
Dari struktur tersebut, Anda pasti melihat bahwa perbedaan kedua senyawa
tersebut terletak pada gugus fungsionalnya. Asam karboksilat bergugus
fungsi –COOH, sedangkan ester bergugus fungsi –COOR. Jadi, atom H pada
asam karboksilat digantikan oleh gugus alkil. Karena memiliki struktur
yang mirip maka penamaan ester, baik IUPAC maupun trivial mirip juga
dengan penamaan asam karboksilat. Kata asam pada asam
karboksilat diganti dengan nama alkil.
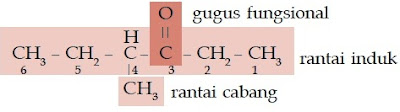
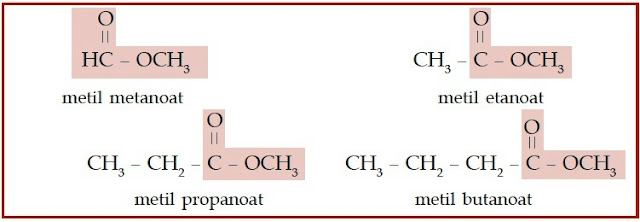
Contoh Soal 10 :
Tentukan nama trivial senyawa ester berikut.
a. CH3 – CH2 – COOCH3
b. CH3 – CH2 – CH2 – COOCH3
c. CH3 – CH2 – CH2 – COOCH2CH3
Kunci Jawaban :
a.
Jumlah atom C pada rantai lurus adalah 3 (propana)
Jumlah atom C pada rantai alkil adalah 1 (metil)
Nama IUPAC: metil propanoat
Nama trivial: metil propionat
b.
Jumlah atom C pada rantai lurus adalah 4 (butana/butirat)
Jumlah atom C pada rantai alkil adalah 1 (metil)
Nama IUPAC: metil butanoat
Nama trivial: metil butirat
c.
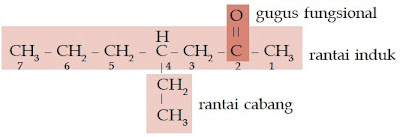
Contoh Soal 10 :
Tentukan nama trivial senyawa ester berikut.
a. CH3 – CH2 – COOCH3
b. CH3 – CH2 – CH2 – COOCH3
c. CH3 – CH2 – CH2 – COOCH2CH3
Kunci Jawaban :
a.
Jumlah atom C pada rantai lurus adalah 3 (propana)
Jumlah atom C pada rantai alkil adalah 1 (metil)
Nama IUPAC: metil propanoat
Nama trivial: metil propionat
b.
Jumlah atom C pada rantai lurus adalah 4 (butana/butirat)
Jumlah atom C pada rantai alkil adalah 1 (metil)
Nama IUPAC: metil butanoat
Nama trivial: metil butirat
c.
Jumlah atom C pada rantai lurus adalah 4 (butana/butirat)
Jumlah atom C pada rantai alkil adalah 2 (etil)
Nama IUPAC: etil butanoat
Nama trivial: etil butirat
Senyawa karbon lainnya yang mengandung gugus karbonil adalah
keton. Penamaan keton mirip dengan penamaan alkohol. Caranya
dengan menggantikan akhiran -ol pada alkohol dengan akhiran -on.
Perhatikan tabel berikut.
Tabel 6. Penamaan IUPAC Senyawa Keton
Jumlah
Atom C
|
Struktur
|
Nama
|
Alkohol
|
2-propanol
|
|
3-pentanol
|
||
3-metil-2-pentanol
|
||
Keton
|
2-propanon
|
|
3-pentanon
|
||
3-metil-2-pentanon
|
Contoh Soal 11 :
Tentukanlah nama senyawa keton berikut.
Kunci Jawaban :
b. Dari struktur kimianya, dapat diketahui bahwa senyawa keton ini memiliki 6 atom C dan gugus –CO-nya berada pada atom C nomor 3 sehingga namanya adalah 3-heksanon.
c.
Senyawa keton ini memiliki rantai lurus yang terdiri atas 6 atom C, gugus –CO berada pada atom C nomor 3, sedangkan gugus metilnya berada pada atom C nomor 4 sehingga namanya adalah 4-metil-3-heksanon.
d.
Senyawa keton ini memiliki rantai lurus yang terdiri atas 7 atom C, gugus –CO berada pada atom C nomor 2, sedangkan gugus metilnya berada pada atom C nomor 4 sehingga namanya adalah 4-etil-2-heptanon.
e.
Senyawa keton ini memiliki rantai lurus yang terdiri atas 5 atom C dan
gugus –CO berada pada atom C nomor 2. Rantai cabangnya berjumlah 3 buah,
yaitu 2 gugus metil yang berada pada atom C nomor 2 dan 4 serta gugus
etil yang berada pada atom C nomor 3 sehingga namanya adalah
3-etil-4,4-dimetil-2- pentanon.
Tata nama keton yang telah diuraikan merupakan nama IUPAC. Selain nama
IUPAC, keton juga memiliki nama trivial (nama lazim). Nama trivial keton
mirip dengan nama trivial eter. Kata eter pada senyawa eter digantikan
dengan kata keton. Perhatikan tabel berikut.
Tabel 7. Penamaan Trivial Senyawa Keton
Jumlah
Atom C
|
Struktur
|
Nama
|
eter
|
CH3 – O – CH3
|
dimetil
eter
|
CH3 – O – CH2
– CH3
|
metil
etil eter
|
|
CH3 – O – CH2
– CH2 – CH3
|
metil
propil eter
|
|
Keton
|
dimetil
keton
|
|
metil
etil keton
|
||
metil
propil keton
|
Contoh Soal 12 :
Tentukan nama trivial senyawa keton berikut.
a. Senyawa keton ini memiliki dua rantai alkil yang jumlah atom C-nya
sama, yakni 2 (etil). Jadi, nama trivialnya adalah dietil keton.
b. Senyawa keton ini memiliki dua rantai alkil yang jumlah atom C-nya berbeda, yakni 2 (etil) dan 3 (propil). Jadi, nama trivialnya adalah etil propil keton.
c. Senyawa keton ini memiliki dua rantai alkil yang jumlah atom C-nya berbeda, yakni 2 (etil) dan 3 (isopropil). Jadi, nama trivialnya adalah etil isopropil keton.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
Bandingkanlah kesimpulan yang Anda peroleh dengan penjelasan berikut.
Tentukan nama trivial senyawa keton berikut.
Kunci Jawaban :
b. Senyawa keton ini memiliki dua rantai alkil yang jumlah atom C-nya berbeda, yakni 2 (etil) dan 3 (propil). Jadi, nama trivialnya adalah etil propil keton.
c. Senyawa keton ini memiliki dua rantai alkil yang jumlah atom C-nya berbeda, yakni 2 (etil) dan 3 (isopropil). Jadi, nama trivialnya adalah etil isopropil keton.
3. Tata Nama Haloalkana
Masih ingatkah Anda dengan senyawa haloalkana? Senyawa haloalkana adalah
senyawa turunan alkana yang satu atom hidrogennya digantikan oleh atom
unsur halogen, seperti fluorin, klorin, bromin, dan iodin. Lakukanlah
kegiatan berikut untuk memahami cara penamaan haloalkana.
Percobaan Kimia Sederhana 5 :
Penamaan Haloalkana
Tujuan :
Menyelidiki aturan penamaan haloalkana
Alat dan Bahan :
Data struktur dan rumus kimia senyawa
Langkah Kerja :
1. Amatilah tabel berikut.
Percobaan Kimia Sederhana 5 :
Penamaan Haloalkana
Tujuan :
Menyelidiki aturan penamaan haloalkana
Alat dan Bahan :
Data struktur dan rumus kimia senyawa
Langkah Kerja :
1. Amatilah tabel berikut.
Jumlah
Atom C
|
Alkana
|
Haloalkana
|
||
Struktur
|
Nama
|
Struktur
|
Nama
|
|
1
|
metana
|
klorometana
|
||
2
|
etana
|
kloroetana
|
||
Jawablah pertanyaan berikut untuk menarik kesimpulan.
- Adakah hubungan antara struktur senyawa alkana dan struktur senyawa haloalkana?
- Bagaimanakah cara memberi nama senyawa haloalkana?
Bandingkanlah kesimpulan yang Anda peroleh dengan penjelasan berikut.
Pada struktur senyawa haloalkana, atom H pada senyawa alkana digantikan
oleh atom halogen, seperti fluorin, klorin, bromin, dan iodin.
Berikut ini aturan penamaan haloalkana.
Aturan Penamaan Senyawa Haloalkana
- Periksa jenis ikatannya. Jika memiliki ikatan tunggal dan mengandung salah satu atom halogen, berarti senyawa tersebut merupakan senyawa haloalkana.
- Tentukan rantai induk dan atom halogennya.
- Beri nomor pada rantai induk sedemikian rupa sehingga atom halogen terikat pada atom C yang paling kecil.
- Rantai induk diberi nama sesuai aturan penamaan senyawa alkana rantai lurus.
- Atom halogen diberi nama sesuai dengan jenis atomnya.
- Tuliskan nomor cabang, diikuti tanda (–), nama atom halogen yang menyambung dengan nama rantai lurus.
Atom
Halogen
|
Nama
Atom
|
Penamaan
dalam Haloalkana
|
F
|
Fluorin
|
Fluoro
|
Cl
|
Klorin
|
Kloro
|
Br
|
Bromin
|
Bromo
|
I
|
Iodin
|
Iodo
|
Agar lebih paham, pelajarilah contoh soal berikut.
Contoh Soal 12 :
Tentukanlah nama senyawa haloalkana berikut.
Kunci Jawaban :
a. Jumlah atom C pada rantai induk: 6 (heksana)
Atom halogen : Cl (kloro)
Penomoran rantai:
Jadi, nama senyawa ini adalah 2-kloroheksana.
b. Jumlah atom C pada rantai induk: 6 (heksana)
Atom halogen : Br (bromo)
Penomoran rantai:
Jadi, nama senyawa ini adalah 3-bromoheksana.
C. Isomer Senyawa Karbon
Di Kelas X, Anda telah mempelajari mengenai isomer, yaitu istilah
bagi kelompok senyawa yang memiliki rumus molekul sama tetapi
berbeda strukturnya. Bagaimanakah dengan senyawa-senyawa karbon
turunan alkana, apakah memiliki isomer juga? Mari, melacaknya dengan
melakukan kegiatan berikut.
Senyawa-senyawa yang rumus kimia dan gugus fungsinya sama,
tetapi struktur molekulnya berbeda disebut isomer posisi. Misalnya,
1-propanol dan 2-propanol. Kedua senyawa ini memiliki rumus kimia C3H8OH dan
sama-sama tergolong senyawa alkohol karena mengandung gugus –OH.
Selain dalam alkohol, isomer juga dapat terjadi pada senyawa turunan
alkana lainnya. Perhatikanlah beberapa contoh isomer berikut.
Ketiga senyawa eter ini memiliki rumus kimia C4H10O.
Kedua senyawa aldehid ini memiliki rumus kimia C4H8O.
Ketiga senyawa keton ini memiliki rumus kimia C5H10O.
Kedua senyawa asam karboksilat ini memiliki rumus kimia C4H8O2.
Kedua senyawa haloalkana ini memiliki rumus kimia C3H7Cl.Ketiga senyawa eter ini memiliki rumus kimia C4H10O.
Kedua senyawa aldehid ini memiliki rumus kimia C4H8O.
Ketiga senyawa keton ini memiliki rumus kimia C5H10O.
Kedua senyawa asam karboksilat ini memiliki rumus kimia C4H8O2.
Kedua senyawa haloalkana ini memiliki rumus kimia C3H7Cl. Jenis
isomer lainnya adalah isomer gugus fungsi, yaitu kelompok senyawa yang
rumus kimianya sama, tetapi gugus fungsinya berbeda. Kelompok senyawa
yang berisomer gugus fungsi adalah alkohol dan eter, aldehid dan keton,
serta asam karboksilat dan ester. Jika suatu senyawa alkohol dan eter
memiliki jumlah atom karbon yang sama maka dipastikan senyawa-senyawa
tersebut merupakan isomer. Demikian juga dengan aldehid, keton, asam
karboksilat, dan ester. Agar Anda lebih memahami, pelajarilah
contoh-contoh berikut.
Senyawa eter dan alkohol tersebut berisomer gugus fungsi karena sama-sama memiliki rumus kimia C4H10O.
Senyawa aldehid dan keton tersebut berisomer gugus fungsi karena sama-sama memiliki rumus kimia C4H8O.
Senyawa aldehid dan keton tersebut berisomer gugus fungsi karena sama-sama memiliki rumus kimia C4H8O.
Senyawa asam karboksilat dan ester tersebut berisomer gugus fungsi karena sama-sama memiliki rumus kimia C4H8O2.
Catatan Kimia :
Senyawa-senyawa yang rumus kimia dan gugus fungsinya sama, tetapi struktur molekulnya berbeda disebut isomer posisi.
D. Identifikasi Senyawa Karbon
Catatan Kimia :
Senyawa-senyawa yang rumus kimia dan gugus fungsinya sama, tetapi struktur molekulnya berbeda disebut isomer posisi.
D. Identifikasi Senyawa Karbon
1. Alkohol dan Eter
Pada umumnya alkohol memiliki titik didih yang tinggi. Hal ini disebabkan alkohol dapat membentuk ikatan hidrogen antar molekul.
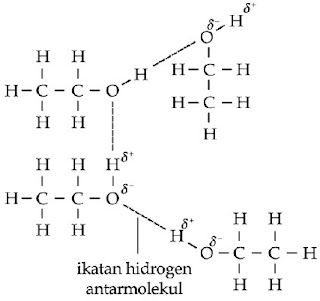 |
| Gambar 8. Ikatan hidrogen antarmolekul pada molekul etanol. |
Dengan bertambahnya rantai karbon, titik didih alkohol menjadi semakin tinggi sehingga menyebabkan kelarutan dalam air menurun.
Tabel 8. Titik didih beberapa senyawa alkohol (1 atm)
Tabel 8. Titik didih beberapa senyawa alkohol (1 atm)
Alkohol
|
Titik Didih (°C)
|
Massa jenis (g/cm3)
|
Kelarutan dalam air (mol/100 g air
pada 20 °C)
|
Metanol
|
0,79
|
Tidak
terhingga
|
|
Etanol
|
0,79
|
Tidak
terhingga
|
|
Propanol
|
0,80
|
Tidak
terhingga
|
|
Butanol
|
0,81
|
0,11
|
|
Pentanol
|
0,82
|
0,030
|
|
Heksanol
|
0,82
|
0,058
|
|
Sumber: Organic Chemistry, 1996
|
|||
Senyawa eter memiliki titik didih lebih rendah jika dibandingkan
dengan alkohol. Hal ini disebabkan karena molekul eter tidak dapat
membentuk ikatan hidrogen.
Tabel 9. Titik Didih Beberapa Senyawa Eter (1 atm)
Eter
|
Titik
Didih (°C)
|
Dimetil eter
|
-24
|
Dietil eter
|
34,6
|
Dipropil eter
|
90,1
|
Sumber: Organic Chemistry, 1996
|
|
Alkohol dan eter dapat dibedakan melalui reaksi dengan logam Na.
Alkohol : R – OH + Na
→ R – ONa + 1/2 H2
2. Aldehid dan Keton
Aldehid tidak dapat membentuk ikatan hidrogen seperti halnya
alkohol sehingga pada senyawa yang memiliki massa molekul yang
sebanding, titik didih aldehid lebih rendah dibandingkan alkohol.
Tabel 10. Titik Didih Beberapa Senyawa Aldehid (1 atm)
Aldehid
|
Titik Didih (°C)
|
Metanal
|
56,2
|
Propanal
|
79,6
|
Butanal
|
102,4
|
Sumber: Organic Chemistry, 1996
|
|
Keton memiliki titik didih yang hampir sama dengan aldehid.
Tabel 11. Titik Didih Beberapa Senyawa Keton (1 atm)
Keton
|
Titik Didih (°C)
|
Propanon (Aseton)
|
56,2
|
2-butanon
|
79,6
|
3-pentanon
|
102,4
|
Sumber: Organic
Chemistry, 1996
|
|
Bagaimanakah cara membedakan aldehid dan keton? Untuk mengetahuinya lakukanlah kegiatan berikut.
Percobaan Kimia Sederhana 6 :
Identifikasi Aldehid dan Keton
Tujuan :
Mengidentifikasi aldehid dan keton dengan pereaksi Fehling dan Tollen’s
Alat dan Bahan :
1. Penangas air
2. Tabung reaksi
3. Gelas ukur
4. Pipet tetes
5. Formaldehid
6. Aseton
7. Pereaksi Fehling
8. Pereaksi Tollen’s
Langkah Kerja :
Sebelum memulai percobaan carilah informasi mengenai senyawa yang akan digunakan, meliputi sifat kimia senyawa, cara penggunaan, dan penanganannya.
Percobaan Kimia Sederhana 6 :
Identifikasi Aldehid dan Keton
Tujuan :
Mengidentifikasi aldehid dan keton dengan pereaksi Fehling dan Tollen’s
Alat dan Bahan :
1. Penangas air
2. Tabung reaksi
3. Gelas ukur
4. Pipet tetes
5. Formaldehid
6. Aseton
7. Pereaksi Fehling
8. Pereaksi Tollen’s
Langkah Kerja :
- Masukkanlah 2 mL formaldehid ke dalam tabung reaksi pertama. Pada tabung reaksi yang berbeda tambahkan 2 mL aseton.
- Tambahkan 3 tetes pereaksi Fehling ke dalam masing-masing tabung reaksi tersebut.
- Panaskan tabung reaksi dengan mengunakan penangas air pada suhu 60 °C.
- Lakukan langkah pada no. 1 dan 2 dengan mengganti pereaksi Fehling dengan pereaksi Tollen’s.
- Amati perubahan yang terjadi.
- Bagaimana hasil reaksi formaldehid dengan pereaksi Fehling dan pereaksi Tollen’s?
- Bagaimana hasil reaksi aseton dengan pereaksi Fehling dan pereaksi Tollen’s?
Sebelum memulai percobaan carilah informasi mengenai senyawa yang akan digunakan, meliputi sifat kimia senyawa, cara penggunaan, dan penanganannya.
Pereaksi Fehling mengandung ion Cu+ dalam
larutan basa. Ketika aldehid direaksikan dengan pereaksi Fehling dan
dipanaskan, aldehid akan teroksidasi menjadi asam karboksilat, sedangkan
pereaksi Fehling akan tereduksi membentuk endapan merah bata Cu2O.
Ketika keton direaksikan dengan pereaksi Fehling dan dipanaskan tidak akan terjadi reaksi.
Pereaksi Tollen’s diperoleh dengan cara melarutkan AgNO3 ke dalam larutan amonia yang menghasilkan senyawa kompleks [Ag(NH3)2]+ Ketika pereaksi Tollen’s dipanaskan dengan aldehid pada tabung reaksi, aldehid akan teroksidasi dan kompleks [Ag(NH3)2]+ tereduksi menjadi logam perak.
Reaksi ini biasa disebut dengan tes cermin perak.
Keton tidak bereaksi dengan pereaksi Tollen's.
3. Asam Karboksilat dan Ester
Asam karboksilat memiliki ikatan hidrogen yang kuat sama seperti alkohol
sehingga memiliki titik didih yang tinggi. Pada senyawa dengan massa
molekul yang sebanding, titik didih asam karboksilat hampir sama dengan
alkohol.
Tabel 12. Titik Didih Beberapa Senyawa Asam Karboksilat (1 atm)
Asam Karboksilat
|
Titik Didih (°C)
|
Asam metanoat
|
31,5
|
Asam etanoat
|
57
|
Asam butanoat
|
120
|
Jika dibandingkan dengan asam karboksilat, ester memiliki titik didih yang rendah.
Tabel 13. Titik Didih Beberapa Senyawa Ester (1 atm)
Ester
|
Titik Didih (°C)
|
Metil metanoat
|
31,5
|
Metil etanoat
|
57
|
Etil butanoat
|
120
|
Salah satu kegunaan ester adalah sebagai bahan pewangi. Bagaimanakah cara membuat ester? Lakukanlah kegiatan berikut.
Percobaan Kimia Sederhana 8 :
Esterifikasi
Tujuan :
Pembuatan ester dari alkohol dan asam karboksilat
Alat dan Bahan :
1. Pipet tetes
2. Gelas ukur
3. Tabung reaksi
4. Gelas kimia
5. Penangas air
6. Etanol
7. Asam asetat (H3COOH)
8. Natrium bikarbonat (NaHCO3)
9. Asam sulfat (H2SO4)
Sebelum memulai percobaan carilah informasi mengenai senyawa yang
akan digunakan, meliputi sifat kimia senyawa, cara penggunaan, dan
penanganannya.
Langkah Kerja :
- Tambahkan 2 mL etanol kepada 1 mL asam asetat pekat dalam tabung reaksi.
- Tambahkan 3 tetes asam sulfat pekat.
- Panaskan campuran di atas penangas air selama 5 menit.
- Pindahkan campuran ke dalam gelas kimia yang telah berisi larutan natrium bikarbonat.
Jawablah pertanyaan berikut untuk menarik kesimpulan.
- Bagaimana aroma dari hasil reaksi dibandingkan reaktan?
- Senyawa apakah yang terbentuk pada reaksi tersebut?
Kerjakanlah secara berkelompok dan diskusikanlah hasil yang Anda peroleh.
Bandingkanlah kesimpulan yang Anda peroleh dengan penjelasan berikut.
Pada saat etanol ditambahkan kepada asam asetat maka akan
terbentuk ester yang memiliki wangi yang khas. Hal ini dipercepat dengan
adanya katalis asam sulfat pekat. Reaksi ini dikenal dengan nama
esterifikasi.
Catatan Kimia :
Saat ini, Indonesia telah mengembangkan jenis bahan bakar otomotif baru yang merupakan campuran antara bensin dan etanol yang menghasilkan bahan bakar dengan kualitas tinggi. Gasohol BE-10 yang diluncurkan oleh BPPT merupakan campuran antara bensin (90%) dan bioetanol (10%). Bioetanol ini diperoleh dari tanaman berpati seperti singkong yang banyak dijumpai di seluruh wilayah Indonesia. Dari sumber nabati ini dapat diproses menjadi sumber energi alternatif yang ramah lingkungan. Sumber: www.bbpt.go.id
Catatan Kimia :
Gasohol
Saat ini, Indonesia telah mengembangkan jenis bahan bakar otomotif baru yang merupakan campuran antara bensin dan etanol yang menghasilkan bahan bakar dengan kualitas tinggi. Gasohol BE-10 yang diluncurkan oleh BPPT merupakan campuran antara bensin (90%) dan bioetanol (10%). Bioetanol ini diperoleh dari tanaman berpati seperti singkong yang banyak dijumpai di seluruh wilayah Indonesia. Dari sumber nabati ini dapat diproses menjadi sumber energi alternatif yang ramah lingkungan. Sumber: www.bbpt.go.id
4. Haloalkana
Haloalkana adalah senyawa turunan alkana yang satu atau lebih atom hidrogennya diganti oleh unsur halogen.
Tabel 14. Titik Didih Beberapa Senyawa Haloalkana (1 atm)
Haloalkana
|
Titik Didih (°C)
|
Wujud pada 25 °C
|
Klorometana
|
-24
|
Gas
|
Kloroetana
|
12
|
Gas
|
Bromometana
|
3
|
Gas
|
Bromoetana
|
38
|
Cair
|
Iodometana
|
42
|
Cair
|
Iodoetana
|
72
|
Cair
|
Sumber: Organic Chemistry, 1996
|
||
Haloalkana dapat mengalami reaksi hidrolisis menghasilkan alkohol.
CH3CH2CH2Br(aq)
+ H2O(l) → CH3CH2CH2OH(aq)
+ HBr(aq)
bromometana propanol
E. Kegunaan Senyawa Karbon
Senyawa alkohol, eter, aldehid, keton, asam karboksilat, dan ester
dapat ditemukan secara alami ataupun dengan cara sintesis di
laboratorium. Senyawa-senyawa karbon ini memiliki beberapa kegunaan,
berikut ini adalah kegunaan senyawa-senyawa karbon tersebut.
1. Kegunaan Alkohol
Metanol merupakan alkohol yang paling sederhana, memiliki titik
didih 64,7 °C. Metanol dikenal sebagai wood alcohol. Metanol digunakan
untuk pembuatan metanal (formaldehid) dan bisa digunakan sebagai
pelarut. Metanol bersifat racun, pada dosis yang rendah dapat
menyebabkan kebutaan dan pada dosis yang tinggi dapat menyebabkan
kematian. Etanol digunakan pada minuman, seperti bir dan anggur. Etanol
juga dicampur dengan bensin (gasoline) menghasilkan campuran yang
dinamakan “gasohol” yang dapat digunakan sebagai bahan bakar. Etanol
digunakan juga sebagai pelarut pada minyak wangi dan sebagai zat
antiseptik.
Etilen glikol merupakan komponen penting untuk pendingin dan
zat antibeku pada kendaraan. Etilen glikol digunakan juga pada pembuatan
polimer. Gliserol dapat diperoleh dari lemak, digunakan sebagai
pelumas, kosmetik, dan bahan makanan. Ketika direaksikan dengan asam
nitrat dapat menghasilkan nitrogliserin yang dapat digunakan sebagai
bahan peledak.
2. Kegunaan Eter
Senyawa eter yang paling banyak dikenal adalah dietil eter. Dietil
eter digunakan sebagai pelarut dan zat anestetik (obat bius). Namun,
penggunaan dietil eter sebagai zat anestetik dapat menyebabkan gangguan
pada pernapasan sehingga saat ini pengunaannya digantikan oleh zat lain
yang tidak berbahaya.
3. Kegunaan Aldehid
Senyawa paling sederhana dari aldehid adalah formaldehid. Formaldehid
digunakan sebagai desinfektan, antiseptik, dan digunakan pada pembuatan
polimer, seperti bakelit. Formaldehid juga banyak digunakan sebagai
pengawet untuk spesimen biologi.
4. Kegunaan Keton
Senyawa keton yang banyak digunakan adalah aseton yang biasanya digunakan sebagai pelarut pada zat dan penghapus cat kuku.
5. Kegunaan Asam Karboksilat
Asam asetat yang dikenal sebagai cuka digunakan sebagai pemberi
rasa asam pada makanan. Senyawa asam karboksilat lainnya, seperti asam
benzoat digunakan sebagai pengawet pada makanan dan minuman. Asam sitrat
dan asam tartrat digunakan sebagai zat aditif pada makanan.
6. Kegunaan Ester
Pada bidang industri, senyawa ester seperti etil etanoat dan
butil butanoat digunakan sebagai pelarut untuk resin dan pernis. Senyawa
ester juga digunakan sebagai pemberi aroma pada makanan dan minyak
wangi, contohnya isoamil etanoat yang memberikan aroma pisang.
7. Kegunaan Haloalkana
Haloalkana digunakan sebagai pelarut, contohnya karbon
tetraklorida (CCl4) dan kloroform (CHCl3). Senyawa haloalkana lainnya
dapat digunakan sebagai insektisida, tetapi saat ini sudah tidak
digunakan lagi karena memiliki efek negatif terhadap kesehatan.
Rangkuman :
- Senyawa karbon turunan alkana terdiri atas alkohol, eter, aldehid, keton, asam karboksilat, ester, dan haloalkana.
- Alkohol dan eter memiliki rumus umum CnH2n+2O Gugus fungsi alkohol adalah –OH dan eter –OR. Senyawa alkohol biasanya digunakan sebagai pelarut dan zat antiseptik, sedangkan senyawa eter sering digunakan sebagai zat anestetik.
- Aldehid dan keton memiliki rumus umum CnH2nO. Gugus fungsi aldehid adalah
 dan keton adalah
dan keton adalah  Senyawa aldehid digunakan sebagai desinfektan dan pengawet, sedangkan keton digunakan sebagai pelarut.
Senyawa aldehid digunakan sebagai desinfektan dan pengawet, sedangkan keton digunakan sebagai pelarut. - Asam karboksilat dan ester memiliki rumus umum CnH2nO2 Gugus fungsi asam karboksilat adalah –COOH dan ester –COOR. Senyawa asam karboksilat sering digunakan sebagai zat aditif dan pengawet, sedangkan ester digunakan sebagai pelarut dan pewangi.
- Haloalkana memiliki rumus umum CnH2n+1X dengan X adalah unsur halogen (F, Cl, Br, I). Haloalkana
- dapat mengalami reaksi hidrolisis menghasilkan alkohol. Haloalkana sering digunakan sebagai pelarut dan insektisida.
artikel ini disalin lengkap dari: http://perpustakaancyber.blogspot.co.id/2013/01/senyawa-karbon-pengertian-struktur-manfaat-kegunaan-sifat.html
halaman utama website: http://perpustakaancyber.blogspot.co.id/
jika mencari artikel yang lebih menarik lagi, kunjungi halaman utama website tersebut. Terimakasih!



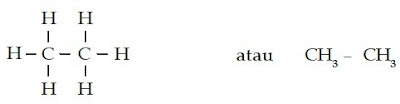

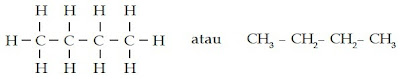




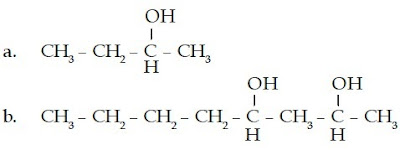

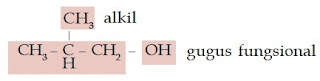
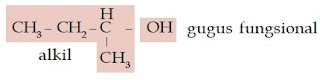





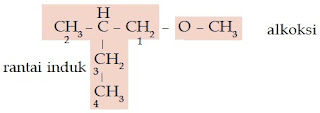


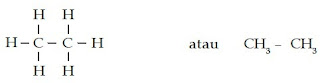












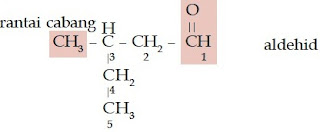
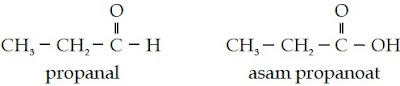
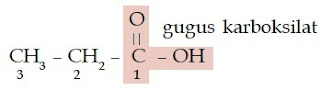
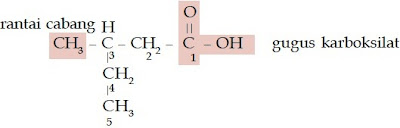


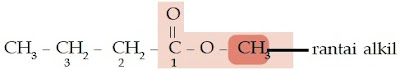
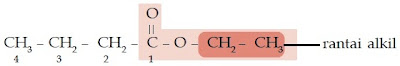












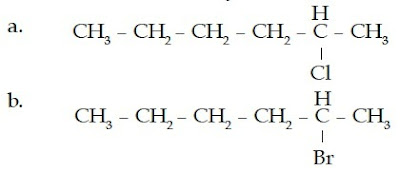
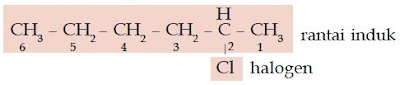
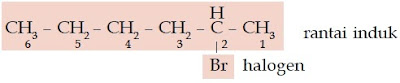


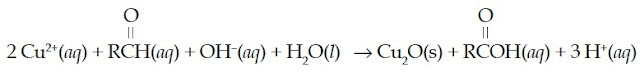
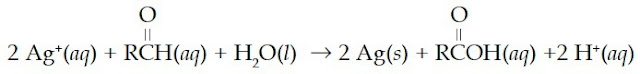
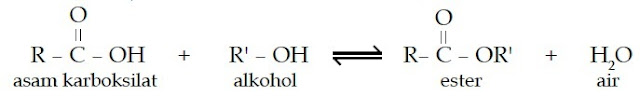
No comments:
Post a Comment