Rumus Tekanan Osmotik
(π), Osmosis, Larutan Hipertonik, Isotonik, Hipotonik, Membran
Semipermiabel, Contoh Soal, Praktikum - Pernahkah kamu sakit dan dirawat
di rumah sakit? Adakalanya seorang pasien di rumah sakit harus diberi
cairan infus. Sebenarnya apakah cairan infus tersebut? Larutan yang
dimasukkan ke dalam tubuh pasien melalui pembuluh darah haruslah
memiliki tekanan yang sama dengan tekanan sel-sel darah. Apabila tekanan
cairan infus lebih tinggi maka cairan infus akan keluar dari sel darah.
Prinsip kerja infus ini pada dasarnya adalah tekanan osmotik. Tekanan
di sini adalah tekanan yang harus diberikan pada suatu larutan untuk
mencegah masuknya molekul-molekul solut melalui membran yang
semipermiabel dari pelarut murni ke larutan.
Sebenarnya apakah osmosis itu? Cairan murni atau larutan encer akan
bergerak menembus membran atau rintangan untuk mencapai larutan yang
lebih pekat. Inilah yang dinamakan osmosis. Membran atau rintangan ini
disebut membran semipermiabel.
Untuk lebih memahami prinsip tekanan osmotik, lakukan percobaan berikut ini.
1. Percobaan / Praktikum Tekanan Osmotik
A. Tujuan
Mempelajari tekanan osmotik.
B. Alat dan Bahan
- Tabung osmotik
- Gelas kimia 400 mL
- Plastik selafon (dari bungkus rokok)
- Aquades
- Larutan sirop berwarna merah
C. Cara Kerja
- Masukkan aquades ke dalam gelas kimia 400 mL hingga 3/4 tinggi gelas.
- Isi tabung osmotik dengan sirop merah dan tutup tabung dengan plastik.
- Masukkan tabung osmotik ke dalam gelas kimia yang berisi aquades tadi.
- Amati dan catat perubahan yang terjadi!
D. Hasil Percobaan
- Perubahan warna aquades dalam gelas kimia = ....
- Perubahan warna sirop dalam tabung osmotik = ....
E. Analisa Data
- Bagaimana proses osmotik yang terjadi pada percobaan ini?
- Apakah kesimpulan dari percobaan ini?
Pada proses osmosis, air mengalir melalui membran semipermiabel masuk ke
dalam larutan sirup, mengencerkan larutan. Molekul sirop tidak dapat
melalui membran. Jadi air yang berada di luar tabung osmotik tetap
murni.
Tekanan osmotik termasuk dalam sifat-sifat koligatif karena besarnya
hanya tergantung pada jumlah partikel zat terlarut. J. H. Vant Hoff
menemukan hubungan antara tekanan osmotik larutan-larutan encer dengan
persamaan gas ideal, yang dituliskan seperti berikut:
Tekanan yang diterapkan untuk menghentikan proses osmosis dari larutan encer atau pelarut murni ke dalam larutan yang lebih pekat dinamakan tekanan osmotik larutan, dilambangkan dengan π. Tekanan osmotik larutan berbanding lurus dengan konsentrasi molar zat. Dalam bentuk persamaan dapat ditulis sebagai berikut. [2]
π ≈ M atau π = k M ............ (1)
k adalah tetapan kesetaraan yang bergantung pada suhu. Untuk larutan encer harga k sama dengan RT, di mana R tetapan gas dan T adalah suhu mutlak.
Oleh karena kemolaran memiliki satuan mol per liter larutan maka tekanan osmotik larutan dapat dinyatakan sebagai berikut.
Tekanan yang diterapkan untuk menghentikan proses osmosis dari larutan encer atau pelarut murni ke dalam larutan yang lebih pekat dinamakan tekanan osmotik larutan, dilambangkan dengan π. Tekanan osmotik larutan berbanding lurus dengan konsentrasi molar zat. Dalam bentuk persamaan dapat ditulis sebagai berikut. [2]
π ≈ M atau π = k M ............ (1)
k adalah tetapan kesetaraan yang bergantung pada suhu. Untuk larutan encer harga k sama dengan RT, di mana R tetapan gas dan T adalah suhu mutlak.
Oleh karena kemolaran memiliki satuan mol per liter larutan maka tekanan osmotik larutan dapat dinyatakan sebagai berikut.
πV = nRT ............ (2)
Keterangan :
π = tekanan osmotik
V = volume larutan (L)
n = jumlah mol zat terlarut
R = tetapan gas (0,082 L atm mol-1 K-1)
T = suhu mutlak (K)
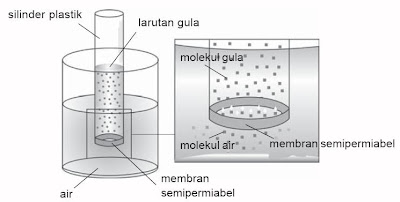 |
| Gambar 1. Proses osmosis (Microsoft Student 2006) |
Membran semipermeabel adalah sejenis plastik berpori yang hanya dapat dilalui oleh molekul-molekul kecil seperti air.
Persamaan (2) dapat juga dituliskan seperti berikut.
Persamaan (2) dapat juga dituliskan seperti berikut.
π =  RT ............ (3)
RT ............ (3)
Ingat bahwa n/V merupakan kemolaran larutan (M), sehingga persamaan (3) dapat diubah menjadi :
π = MRT ............ (4)
Contoh Soal 1 :
Seorang pasien memerlukan larutan infus glukosa. Bila kemolaran cairan
tersebut 0,3 molar pada suhu tubuh 37 °C, tentukan tekanan osmotiknya!
(R = 0,082 L atm mol-1 K-1)
Penyelesaian:
Diketahui :
M = 0,3 mol L-1
T = 37 °C + 273 = 310 K
R = 0,082 L atm mol-1 K-1
Ditanya : π ...?
Jawaban :
π = 0,3 mol L-1 x 0,082 L atm mol-1 K-1 x 310 K = 7,626 L
Dalam sistem analisis, dikenal larutan hipertonik yaitu larutan yang
mempunyai konsentrasi terlarut tinggi, larutan isotonik yaitu dua
larutan yang mempunyai konsentrasi terlarut sama, dan larutan hipotonik
yaitu larutan dengan konsentrasi terlarut rendah. Air kelapa merupakan
contoh larutan isotonik alami.
Secara ilmiah, air kelapa muda mempunyai komposisi mineral dan gula yang
sempurna sehinggga memiliki kesetimbangan elektrolit yang nyaris
sempurna setara dengan cairan tubuh manusia.
Proses osmosis juga terjadi pada sel hidup di alam. Contoh bintang laut
dan kepiting memiliki cairan sel yang bersifat isotonik dengan
lingkungannya. Jika cairan sel bersifat hipotonik maka sel tersebut akan
mendapatkan banyak air. Tetapi jika sel berada pada larutan hipertonik
maka sel akan kehilangan banyak molekul air.
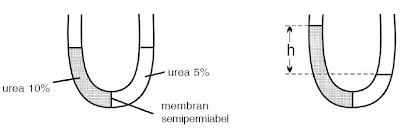 |
| Gambar 2. Proses tekanan osmosis pada larutan urea 10% dan 5%. (Ilustrasi : Haryana) [1] |
Dengan diketahuinya tekanan osmotik suatu larutan maka massa molekul
relatif dari zat terlarut dapat ditentukan. Hal ini dilakukan dengan
cara menata ulang persamaan tekanan osmotik menjadi: [2]
Mr = RT
RT
Contoh Soal 2 : [1]
Mr =
Contoh Soal 2 : [1]
Sebanyak 3 gram urea (Mr = 60) dilarutkan dalam air hingga volume larutan 500 mL. Hitunglah tekanan osmotik larutan pada suhu 27 °C!
Pembahasan :
π = M . R . T =  R . T
R . T
π =  . 0,082 L atm mol-1 K-1 . 300 K
. 0,082 L atm mol-1 K-1 . 300 K
π = 0,1 . 0,082 . 300 atm
π = 2,46 atm
2. Penerapan Tekanan Osmotik dan Osmosis [1]
Selain menggunakan penurunan tekanan uap, kenaikan titik didih dan
penurunan titik beku, pengukuran tekanan osmosis juga dapat digunakan
untuk menentukan massa molekul relatif (Mr)
suatu senyawa. Untuk larutan yang sangat encer, pengukuran tekanan
osmotik lebih akurat dibanding pengukuran titik didih atau titik beku
sehingga penentuan massa molekul relatif dengan mengukur tekanan osmotik
akan lebih teliti. Peristiwa osmosis dapat dimanfaatkan untuk
penyediaan cairan infus dan industri pengolahan air laut menjadi air
tawar dengan osmosis balik.
 |
| Gambar 3. Alat untuk mengukur tekanan osmosis. [1] |
Contoh Soal 3 : [1]
Sebanyak 17,1 gram suatu zat non elektrolit dilarutkan dalam air hingga
volume larutan 1 liter. Ternyata pada suhu 27 °C larutan yang terjadi
memiliki tekanan osmotik sebesar 1,23 atm. Berapakah massa molekul
relatif zat tersebut?
Penyelesaian :
π = M . R . T
1,23 = M . 0,082 . 300
M =  = 0,05 M
= 0,05 M
M = 
0,05 = 
Mr = 
Mr = 342
No comments:
Post a Comment